- Pyrithion
-
Strukturformel 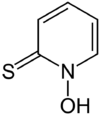
Allgemeines Name Pyrithion Andere Namen - Pyridin-2-thiol-1-oxid
- Omadin
- PTO
Summenformel C5H5NOS CAS-Nummer - 1121-30-8 (Enthiolform)
- 1121-31-9 (Thionform)
PubChem 1570 Kurzbeschreibung beigefarbener bis grau-schwarzer Feststoff mit übelem Geruch[1][2]
Eigenschaften Molare Masse 127,18 g·mol−1 Aggregatzustand fest
Siedepunkt Löslichkeit schlecht in Wasser (2,5 g·l−1 bei 20 °C)[3]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [4] 
Gefahr
H- und P-Sätze H: 301-315-319-335 EUH: keine EUH-Sätze P: 261-301+310-305+351+338 [4] EU-Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22-36/37/38 S: 26-36/37 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Pyrithion ist eine organische Verbindung. Sie besteht aus einem Pyridinring, welcher am Stickstoffatom oxidiert ist (Pyridin-N-oxid) und in 2-Position eine Thiolfunktion trägt. Es ist ein Fungizid und Bakterizid.[3]
Inhaltsverzeichnis
Darstellung
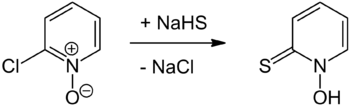
Zur Herstellung der Verbindung wird zunächst Natriumhydrogensulfid zur Reaktion gebracht, woraus das Natriumsalz des Pyrithions entsteht. Pyrithion kann hieraus durch Neutralisation mit Säuren freigesetzt werden.[3]
Eigenschaften
Pyrithion ist ein übelriechender Feststoff[2], der bei 69–72 °C schmilzt[1]. Er besitzt nur eine geringe Wasserlöslichkeit von 2,5 g·l−1 bei 20 °C.[1]
Es liegt ein Gleichgewicht zwischen den tautomeren Enthiol- und Thionformen vor (Thiolactam-Thiolactim-Tautomerie).[3]
Verwendung
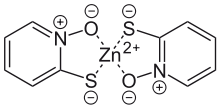
Pyrithion kann zur Herstellung von Zink-Pyrithion verwendet werden, welches zur Anwendung gegen Hautschuppen[5] und in pilzhemmenden Anstrichen verwendet wird. Natrium-Pyrithion, das als Antimykotikum verwendet wird, kann durch Reaktion mit Natriumsalzen hergestellt werden.[3] Die Herstellung des Bakterizids und Fungizids Dipyrithion gelingt durch oxidative Dimerisierung.[3]
Ebenfalls kann Pyrithion zur Herstellung von Copolymeren der Cellulose verwendet werden. Diese Polymerisation verläuft radikalisch.[3]
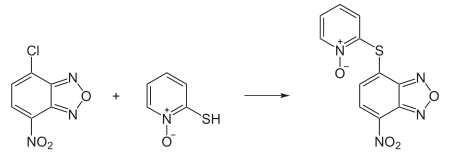
In der Chemie wird Pyrithion zur Herstellung von Barton-Estern, die zur Barton-McCombie-Decarboxylierung benötigt werden, eingesetzt. Derivatisiert mit 4-Chlor-7-nitrobenzo-2-oxa-1,3-diazol (NDB-Cl) dient Pyrithion in der chemischen Analytik zur UV-Fluoreszenz-Detektion in HPLC-Messungen.
Einzelnachweise
- ↑ a b c d Datenblatt Pyrithion bei AlfaAesar, abgerufen am 6. Juni 2010 (JavaScript erforderlich).
- ↑ a b Datenblatt Pyrithion bei Acros, abgerufen am 6. Juni 2010.
- ↑ a b c d e f g h Ullrich Jahn, in: Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b Datenblatt 2-Mercaptopyridine N-oxide bei Sigma-Aldrich, abgerufen am 22. April 2011.
- ↑ C. J. Chandler, I. H. Segel: „Mechanism of the antimicrobial action of pyrithione: effects on membrane transport, ATP levels, and protein synthesis“, in: Antimicrob. Agents Chemother., 1978, 14, S. 60–68; PMC 352405.
Wikimedia Foundation.