- Swainsonin
-
Strukturformel 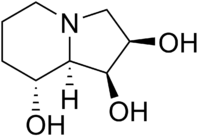
Allgemeines Name Swainsonin Andere Namen - (1S,2R,8R,8aR)-1,2,8-Trihydroxyindolizidin
- Tridolgosir
Summenformel C8H15NO3 CAS-Nummer 72741-87-8 PubChem 51683 Kurzbeschreibung weißer kristalliner Feststoff
Eigenschaften Molare Masse 173,21 g·mol−1 Aggregatzustand fest
Schmelzpunkt 146-147 °C
Löslichkeit leicht löslich in Wasser
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 
Achtung
H- und P-Sätze H: 302-312-332 EUH: keine EUH-Sätze P: 280 [1] EU-Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 20/21/22 S: 36 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Swainsonin ist ein in der Natur vorkommendes Indolizidin-Alkaloid mit starker pharmakologischer Wirkung. Sainsonin hemmt reversibel die Enzyme α-Mannosidase im Lysosom und Golgi-α-Mannosidase II von Zellen, was zu einer Akkumulation von mannosereichen Oligosacchariden im Lysosom dieser Zellen führt. Bei Weidetieren, die Swainsonin über die Nahrung aufnehmen, kann dies zum sogenannten Locoismus, einer induzierten Mannosidose, führen.[2]
Inhaltsverzeichnis
Vorkommen
- →siehe Hauptartikel Locoweed
Swainsonin ist das Toxin in Locoweed. Das sind mehrere Pflanzengattungen und Pilzarten, die vor allem im Westen Nordamerikas vorkommen. Der Verzehr dieser Pflanzen führt bei Weidetieren zum so genannten Locoismus, einer schweren neurologischen Erkrankung.
Biosynthese
Die Biosynthese von Swainsonin wurde bei dem parasitären Pilz Rhizoctonia leguminicola ausführlich untersucht. Aus L-Lysin wird zunächst 2-Aminoadipinsäuresemialdehyd, das unmittelbar zur Δ1-Piperidin-6-carbonsäure cyclisiert. Über die Zwischenprodukte 1-Ketooctahydroindolizin entsteht letztlich das Swainsonin.[3][4]
Pharmakologisches Potenzial
Swainsonin und einige seiner Epimere zeigen im Tierversuch eine starke pharmakologische Wirkung.[5] Die Bildung von Metastasen und das Tumorwachstum werden unterdrückt. Daneben wird die Bildung von NK-Zellen und das makrophagenmediierte Abtöten von Tumorzellen stimuliert. Ebenso wird im Knochenmark die Proliferation von Zellen aktiviert.[6][7] Als Inhibitor der lysosmalen α-Mannosidase wird die Bildung von tumorspezifischen Glycosylierungsmustern unterbunden und die katabolischen Glykosidasen gehemmt. Beides führt im Tierversuch zu einem verminderten Tumorwachstum und einer Reduzierung der Metastasenbildung.[8][9]
Swainsonin befindet sich derzeit in der klinischen Erprobung.[4] In einer Phase-II-Studie konnte bei den behandelten Patienten mit fortgeschrittenem oder metastatisiertem Nierenzellkarzinom jedoch keine Anti-Tumor-Wirkung gezeigt werden.[10]
Swainsonin ist ein Appetitzügler.[11]
Die Giftwirkung bei Weidetieren beruht auf der Inhibierung des Enzyms α-Mannosidase. Die Symptome bei Locoismus ähneln daher denen einer α-Mannosidose, einer genetischen Erkrankung.[12] Swainsonin hemmt reversibel die Enzyme α-Mannosidase im Lysosom und Golgi-α-Mannosidase II von Zellen, was zu einer Akkumulation von mannosereichen Oligosacchariden im Lysosom führt.[4]
Entdeckung
Swainsonin wurde erstmals 1973 aus dem Pilz Rhizoctonia leguminicola[13] und später aus der namensgebenden Leguminose Swainsona canescens[14] und Astragalus lentiginosus[15] isoliert.[4]
Weiterführende Literatur
- G. G. Habermehl u. a.: Naturstoffchemie: Eine Einführung. Springer Verlag, 2008, ISBN 3-540-73732-4, S. 209–211.
- J. B. Astroga u. a.: Maternal ingestion of locoweed: II. The ability of intoxicated ewes to discriminate their own lamb. In: Small Ruminant Research 65, 2006, S. 64–69.
- Y. Sichhart: Gene, Enzyme und Produkte der Calysteginbildung in Calystegia sepium (L.) R. Br. Dissertation, Martin-Luther-Universität Halle-Wittenberg, 2003
- A. G. Armien: Vergleichende klinische und morphologische Untersuchungen zur spontanen und experimentellen Vergiftung durch Ipomoea fistulosa (Convolvulaceae) bei Ziegen. Dissertation, Justus-Liebig-Universität Gießen, 2000
- M. H. Ralphs und L. F. James: Locoweed grazing. In: J Nat Toxins 8, 1999, S. 47–51. PMID 10091127 (Review)
- D. R. Tulsiani u. a.: Swainsonine induces the production of hybrid glycoproteins and accumulation of oligosaccharides in male reproductive tissues of the rat. In: Biol Reprod 43, 1990, S. 130–138. PMID 2118392
- M. D. Skudlarek und M. C. Orgebin-Crist: Effect of swainsonine on rat epididymal glycosidases. In: J Reprod Fert" 84, 1988, S. 611–617. PMID 3143832
- D. R. Tulsiani u. a.: Production of hybrid glycoproteins and accumulation of oligosaccharides in the brain of sheep and pigs administered swainsonine or locoweed. In: Arch Biochem Biophys 264, 1988, S. 607–617. PMID 3135781
- D. R. Tulsiani u. a.: The similar effects of swainsonine and locoweed on tissue glycosidases and oligosaccharides of the pig indicate that the alkaloid is the principle toxin responsible for the induction of locoism. In: Arch Biochem Biophys 232, 1984, S. 76–85. PMID 6430242
- D. R. Tulsiani u. a.: Swainsonine inhibits the biosynthesis of complex glycoproteins by inhibition of golgi mannosidase II. In: J Biol Chem 257, 1982, S. 7936–7939. PMID 6806288
Einzelnachweise
- ↑ a b c Datenblatt Swainsonine bei Sigma-Aldrich, abgerufen am 23. April 2011.
- ↑ P. R. Dorling u. a.: Lysosomal storage in Swainsona spp. toxicosis: an induced mannosidosis. In: Neuropathol Appl Neurobiol 4, 1978, S. 285–295. PMID 703929.
- ↑ C. M. Harris u. a.: Biosynthesis of swainsonine in the Diablo locoweed (Astragalus oxyphysus). In: Tetrahedron Lett 29, 1988, S. 4815–4818.
- ↑ a b c d G. Heimgärtner: [http://deposit.ddb.de/cgi-bin/dokserv?idn=980395275&dok_var=d1&dok_ext=pdf&filename=980395275.pdf Synthese von polyhydroxylierten Indolizidinalkaloiden und γ-Aminosäuren. Dissertation, Universität Regensburg, 2005.
- ↑ A. A. Watson u. a.: Polyhydroxylated alkaloids - natural occurrence and therapeutic applications. In: Phytochemistry 56, 2001, S. 265–295. PMID 11243453
- ↑ K. Olden u. a.: The potential importance of swainsonine in therapy for cancers and immunology. In: Pharmacol Ther 50, 1991, S. 285–290, PMID 1754603.
- ↑ J. Y. Sun u. a.: Inhibition of the growth of human gastric carcinoma in vivo and in vitro by swainsonine. In: Phytomedicine 14, 2007, S. 353–359, PMID 17097281.
- ↑ J. W. Dennis u. a.: Growth inhibition of human melanoma tumor xenografts in athymic nude mice by swainsonine. In: Cancer Res 50, 1990, S. 1867-1872, PMID 2106389.
- ↑ R. Keiner: Calystegine in Solanum tuberosum L. - Klonierung, Expression und Charakterisierung der Tropinonreduktasen I und II, putativer Enzyme des Tropanalkaloidstoffwechsels. Dissertation, Martin-Luther-Universität Halle-Wittenberg, 2001.
- ↑ P. E. Shaheen u. a.: Phase II study of the efficacy and safety of oral GD0039 in patients with locally advanced or metastatic renal cell carcinoma. In: Investigational New Drugs 23, 2005, S. 577–581, PMID 16034517.
- ↑ D. H. Pritchard u. a.: Swainsonine toxicosis suppresses appetite and retards growth in weanling rats. In: Research in Veterinary Science 48, 1990, S. 228–230, PMID 2110378.
- ↑ J. L. Ríos und P. G. Waterman: A review of the pharmacology and toxicology of Astragalus. In: Phytotherapy Research 11, 1997, S. 411–418. doi:10.1002/(SICI)1099-1573(199709)11:6<411::AID-PTR132>3.0.CO;2-6 ISSN 0951-418X.
- ↑ F. P. Güngerich u. a.: Isolation and characterization of a l-pyrindine fungal alkaloid. In: JACS 95, 1973, S. 2055–2056, doi:10.1021/ja00787a080.
- ↑ S. M. Colegate u. a.: A spectroscopic investigation of swainsonine: an α-mannosidase inhibitor isolated from Swainsona canescens. In: Aust J Chem 32, 1979, S. 2257–2264, doi:doi:10.1071/CH9792257.
- ↑ R. J. Molyneux und L. F. James: Loco intoxication: indolizidine alkaloids of spotted locoweed (Astragalus lentiginosus). In: Science 216, 1982, S. 190–191, PMID 6801763.
Wikimedia Foundation.


