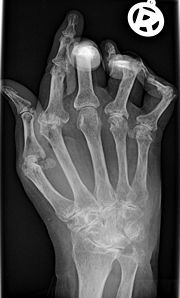
- Chronische Polyarthritis
-
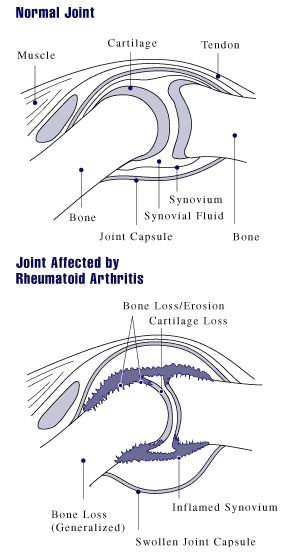
Klassifikation nach ICD-10 M05 Seropositive chronische Polyarthritis M06 Sonstige chronische Polyarthritis ICD-10 online (WHO-Version 2006) Die rheumatoide Arthritis (auch chronische Polyarthritis) ist die häufigste entzündliche Erkrankung der Gelenke. Der Krankheitsbeginn ist oft plötzlich, mit Schmerzen in den kleinen Finger- oder Zehengelenken. Es können auch andere Gelenke betroffen sein, insbesondere Hand-, Knie-, Schulter, Fuß-, Hüftgelenke. Typischerweise werden bevorzugt die Handwurzelknochen, die Fingergrundgelenke (Metacarpophalangealgelenk) und die proximalen Interphalangealgelenke (PIP) befallen. Die Finger- und Zehenendgelenke (distale Interphalangealgelenke, DIP) sind, im Gegensatz zu Gicht, nicht betroffen. Die betroffenen Gelenke schwellen an und sind überwärmt. Eine Rötung der betroffenen Gelenke kann hinzukommen. Eine symmetrische (= beidseits auftretende) Synovitis der stammfernen Gelenke ist typisch aber nicht zwingend. Morgens sind diese Symptome zumeist am stärksten ausgeprägt; es handelt sich dabei um die symptomatische Morgensteife. Im Krankheitsverlauf werden immer mehr Gelenke befallen.
Meist verläuft die Krankheit schubweise, ein Schub dauert typischerweise zwischen einigen Wochen bis Monaten an. Zwischen den einzelnen Schüben lassen die Beschwerden nach. Die Behandlung ist dadurch erschwert, da eine Besserung des Gesundheitszustandes nicht zwingend auf die Therapie zurückzuführen ist.
Abgekürzt wird die Krankheit mit RA (rheumatoide Arthritis), pcP (primär chronische Polyarthritis, veraltet) oder cP (chronische Polyarthritis).
Sonderformen der Rheumatoiden Arthritis sind das Felty-Syndrom, das Caplan-Syndrom und die Juvenile idiopathische Arthritis.
Inhaltsverzeichnis
Epidemiologie (Häufigkeit, Geschlechts- und Altersverteilung)
Abgesehen von der entzündlich aktivierten Arthrose ist die rheumatoide Arthritis die häufigste entzündliche Gelenkerkrankung. Weltweit sind etwa 0,5–1 % der Bevölkerung betroffen. In Deutschland schätzt man die Zahl der Erkrankungen auf 800.000, wobei Frauen rund drei mal so häufig betroffen sind wie Männer. An der rheumatoiden Arthritis können Menschen aller Altersgruppen erkranken. Häufig ist ein Auftreten zwischen 35 und 45 Jahren. Es können jedoch auch Kinder betroffen sein; dies nennt man dann eine juvenile idiopathische Arthritis. Die Prävalenz nimmt mit steigendem Alter zu. Als Gipfel der Neuerkrankungsrate wird bei Frauen das Alter zwischen 55 und 64 Jahren, bei Männern das Alter zwischen 65 und 75 Jahren gesehen.
Ursache
Die Ursache der Erkrankung ist bislang ungeklärt. Es wird eine autoimmune Ursache angenommen, bei der körpereigene Substanzen, z. B. der Gelenkknorpel, von Zellen des Immunsystems angegriffen werden. Es wurde lange vermutet, dass auslösend auch Viren oder Bakterien eine Rolle spielen, jedoch sprechen neuere Daten dagegen. Außerdem konnte ein genetischer Einfluss unter anderem durch Zwillingsstudien nachgewiesen werden. RA ist mit bestimmten MHC- bzw. HLA-Allelen assoziiert.
Pathogenese
Das klinische Bild der Rheumatoiden Arthritis ist die Projektion struktureller Prozesse, die sich im artikulären und extrartikulären Gewebe des Organismus abspielen: Strukturelle Forschung zeigt als Vollbild der Erkrankung einen Komplex aus immunologischer Gelenkentzündung, onkologischer Gelenkdestruktion und extraartikulären, u. U. sogar tödlichen primär nekrotisierenden Prozessen.[1] Die seit weit über hundert Jahren tradierte Vorstellung einer rein entzündlichen Erkrankung beruht auf wechselnd bewerteten klinisch-immunologischen Phänomenen und soll im folgenden Absatz dargestellt werden, findet aber in der Analyse der strukturellen Prozesse keine Stütze:
Es wird beschrieben, dass fehlgesteuerte Immunzellen in das betroffene Gelenk einwandern und dort entzündungsfördernde Botenstoffe produzieren – sogenannte Zytokine –, mit deren Hilfe Immunzellen miteinander kommunizieren. An der Zellmembran der Zielzelle befinden sich Rezeptoren, an welche die Zytokinmoleküle nach dem Schlüssel-Schloss-Prinzip andocken und dort die entsprechenden Reaktionen auslösen können. Bei den Erkrankten ist der Theorie nach dieses Gleichgewicht zwischen den Zytokinen gestört. Insbesondere Interleukin-1 (IL-1) und der Tumornekrosefaktor-alfa (TNF-α) seien übermäßig vorhanden und für den zerstörerischen Entzündungsprozess im Knorpelgewebe und die Aktivierung knochenabbauender Zellen, der Osteoklasten, verantwortlich. Durch die Wirkung der Zytokine entstehe an der Gelenkinnenhaut (Synovialis) ein geschwulstartiges Gewebe, der Pannus, welcher nach einer gewissen Zeit Knorpel, Knochen und auch andere Strukturen des betroffenen Gelenks zerstöre.
Der Entzündungsprozess wird jedoch nach Untersuchungen des Zentrums für Rheuma-Pathologie, Mainz, als im Verhältnis zu anderen, ebenfalls immunologisch ausgelösten entzündlichen Gelenkerkrankungen gering eingeschätzt. Obwohl in dieser meist der Grund für die starke Zerstörung des Gelenks gesehen wird, wurde niemals ein Beweis für die Destruktion von Knochen und Knorpel durch eine immunologische Entzündung erbracht.
Die Gelenkzerstörung bei Rheumatoider Arthritis ist vielmehr das Werk eines spezifischen onkologischen Prozesses, der sich schubweise aus der pluripotenten synovialen Zellmatrix entwickelt.[2] [3] Die aggressiven homogenen Zellverbände, die in Knorpel und Knochen eindringen, bestehen aus dicht gelagerten großen polygonalen Zellen. Der große helle Zellkern enthält 1 bis 2 Nucleolen. Diese Zellen exprimieren eine Reihe hochpotenter proteolytischer Enzyme, die sie zur schnellen Zerstörung des Gelenks durch Degradierung von Knorpel und Knochen befähigen. Der gefäßfreie Prozess ist kurzlebig, die aggressiven Zellverbände kollabieren innerhalb weniger Tage und werden von Entzündungszellen und Makrophagen resorbiert. Entzündliche Faktoren sind am Zerstörungsprozess nicht beteiligt. Der Prozess hinterlässt jedoch den bekannten, oft fälschlich der Entzündung zugeschriebenen Pannus. Diese aggressive Phase kann sich am gleichen Gelenk wiederholen und den Zerstörungsprozess fortsetzen. Dieser für die Rheumatoide Arthritis spezifische Prozess wurde vom Deutschen Krebsforschungszentrum als „tumor-like proliferation“ klassifiziert.
Eine weitere potenziell tödliche Komponente der Rheumatoiden Arthritis ohne entzündliche Interferenz ist das akute Absterben von Geweben infolge einer lokalen Freisetzung von Kollagenasen. Es sind gelenkferne Prozesse, die durch eine zentrale Nekrose und eine dichte radiäre Zellpalisade gekennzeichnet sind. Sie zerstören gefäßarme, kollagene Strukturen. In Sehnen führen sie zur Sehnenruptur, im Auge befallen sie die Sklera, was zum Verlust des Auges führt. Sie können die Wandung von Arterien zerstören und damit zum Absterben von Gliedmaßen führen. Dies sind Prozesse, die sich der klinischen Beobachtung weitgehend entziehen und deswegen oftmals anderen Erkrankungen zugeschrieben werden (z. B. Herzinfarkt).[1]
Diagnostik
Die Diagnostik erfolgt durch Labor, Klinik und bildgebende Verfahren.
- Labor: Es wird nach Rheumafaktoren (RF-Antikörper) im Blut gesucht, die Blutsenkungsgeschwindigkeit (BSG) und das C-reaktive Protein (CRP) getestet. Rheumafaktoren (RF) sind hierbei jedoch nicht beweisend, sondern nur hinweisend, kann man auch bei anderen Erkrankungen Rheumafaktoren nachweisen. Fälle von seronegativer Arthritis sind ebenso bekannt wie Fälle, in denen Betroffene einen so niedrigen RF aufweisen, dass er zur Diagnostik nicht ausreicht.
- In neuerer Zeit haben die Testsysteme zum Nachweis der so genannten ACPAs (anti-citrullinated protein/peptide antibodies, Antikörper gegen citrullinierte Proteine/Peptide) die klassische Serodiagnostik über die Rheumafaktoren verbessert. Prominenteste Vertreter der ACPA-Testsysteme sind der CCP-Assay und der Nachweis von Autoantikörpern gegen Mutiertes Citrulliniertes Vimentin (Anti-MCV-ELISA). Beide erreichen Sensitivitäten von nahezu 80% und eine Spezifitäten von nahezu 98%.
- Klinik: Zählung und Lokalisation schmerzhafter, geschwollener und überwärmter Gelenke, Patientenselbsteinschätzung
- Bildgebende Verfahren: Zu Beginn und im Verlauf sind Röntgen- oder MRT-Untersuchungen erforderlich, um Schädigungen der Knochen (Erosionen) abschätzen zu können. Typische radiologische Befunde sind subchondrale Osteoporose, Destruktionen des umliegenden Knochens, Ankylosen und Gelenkfehlstellungen (Knopflochdeformität, Schwanenhalsdeformität, Ulnardeviation).
- Mit der Weichteil- und Knochenszintigraphie kann das Verteilungsmuster der Entzündungsaktivität der verschiedenen Gelenke recht gut dargestellt werden.
Dabei werden für die Diagnose üblicherweise die folgenden Kriterien des „American College of Rheumatology (ACR)“ von 1987 herangezogen:
- Morgensteifigkeit in mindestens einem Gelenk für mindestens eine Stunde
- Gelenkentzündungen in mindestens drei verschiedenen Gelenkregionen
- Gelenkentzündungen an Hand- oder Fingergelenken
- Beidseitige Gelenkentzündungen derselben Gelenke beider Körperhälften
- Rheumaknoten
- Nachweis von Rheumafaktoren
- Radiologische Veränderungen der Gelenke
Die ersten vier Kriterien müssen über einen Zeitraum von mindestens sechs Wochen vorliegen und mindestens vier dieser sieben Kriterien erfüllt sein.
Therapie
Medikamentöse Behandlung
Bei der medikamentösen Therapie rheumatischer Erkrankungen werden traditionell vier Hauptgruppen von Medikamenten unterschieden:
- Analgetika (Schmerzmittel)
- nicht-steroidale Antiphlogistika NSAID
- Glucocorticoide
- Basistherapeutika, Langwirksame Antirheumatika (LWAR), krankheitskontrollierende Medikamente (Disease modifying anti-rheumatic drugs, DMARD)
Die verschiedenen Medikamentengruppen haben unterschiedliche Wirkungen und therapeutische Zielsetzungen. Ihre Anwendung erfolgt deshalb oft gleichzeitig, z. B. gibt man häufig neben langwirksamen Antirheumatika zusätzlich Cortison oder cortisonfreie Entzündungshemmer.
Moderne Konzepte der Rheumabehandlung zeichnen sich dadurch aus, dass verschiedene Methoden miteinander kombiniert werden. Der Erfolg der Behandlung hängt wesentlich davon ab, für die unterschiedlichen Krankheitsbilder und -situationen die jeweils richtige Behandlungskombination zusammenzustellen. Für jeden einzelnen Patienten muss eine individuelle Therapie quasi „maßgeschneidert“ werden. Sehr häufig wird dabei allein oder in Kombination das Basistherapeutikum MTX (Methotrexat) eingesetzt, quasi der "Goldstandard" der Basistherapie.
Neuere Therapeutika sind in Form von Antikörpern, löslichen Rezeptoren oder Antagonisten gegen proinflammatorische Zytokine wie IL-1 oder TNF-alpha gerichtet. Zu den Biologicals, die gegen TNF-alpha gerichtet sind, zählen die TNF-alpha-Antikörper Infliximab und Adalimumab sowie der lösliche TNF-alpha-Rezeptor Etanercept. Der IL-1-Rezeptor-Antagonist heißt Anakinra. Eine neue Perspektive eröffnet die B-Zell-Therapie mit Rituximab (monoklonaler CD20-Antikörper), die seit Juli 2006 europaweit zugelassen ist. Aktuelle Daten aus wissenschaftlichen Studien belegen die Langzeit-Wirksamkeit und -sicherheit der Therapie im klinischen Alltag. Rituximab wird derzeit nach Versagen des ersten TNF-alpha-Antikörpers eingesetzt. Die B-Zell-Therapie kann alle 6 Monate wiederholt werden. In Phase II und Phase III-Studien befinden sich zudem die Wirkstoffe Tocilizumab (IL-6-Rezeptorblocker) und Ocrelizumab (humanisierter CD20-Antikörper).
Natriumaurothiomalat: Wie alle Medikamente auf Gold-Basis hat dieses erhebliche Nebenwirkungen und braucht lange Zeit, um die gewünschte Hauptwirkung zu entfalten. Heute wird es daher selten verwendet. Die Erfahrung der älteren Rheumatologen zeigt jedoch, das das Gold in Spritzenform (nicht als Tablette) für einige Patienten ein sehr effektives Medikament ist.
Operative Therapie der rheumatischen Arthritis
Als Zweig der Orthopädie hat sich die Rheumachirurgie etabliert. Die sie anwendenden Ärzte haben sich darauf spezialisiert, die schweren und bisweilen schwersten Gelenkveränderungen, die im Laufe einer rheumatischen Erkrankung entstehen können, operativ zu behandeln.
Synovektomie
Die Synovialis (= Gelenkskapsel) ist der eigentliche Ort des Krankheitsgeschehens. Im frühen Stadium kann es sich sehr gut auf den gesamten Verlauf auswirken, diese operativ zu entfernen. Abhängig von den anatomischen Gegebenheiten des betroffenen Gelenkes gelingt das oft nicht vollständig, aber eine deutliche Reduktion des erkrankten Gewebes hat meist einen lindernden Effekt. Synovialgewebe ist auch in den Sehnenscheiden vorhanden. Normalerweise sorgt es dort für die Ernährung und Schmierung der Sehnen. Bei rheumatischen Erkrankungen bilden sich, besonders in den Strecksehnenfächern des Handrückens, starke Schwellungen, so genannte synovitische Kissen, aus. Die krankhaft veränderte Synovia greift diese Sehnen an, die Sehnen können zerreißen. Die frühe Synovektomie wirkt sich bremsend auf den Krankheitsprozess aus.
Im späteren Verlauf, wenn es zu Zerstörungen von Gelenken gekommen ist, reichen solche, relativ kleinen Eingriffe, nicht mehr aus. Abhängig von der Lokalisation, dem Typ und der Funktion des Gelenkes kommen verschiedene Verfahren zum Einsatz.
Gelenkresektion
Das zerstörte Gelenk wird ersatzlos entfernt. Die Nachbehandlung mit Gips und Schienen hat zum Ziel, eine funktionell zufrieden stellende Narbenbildung zu ermöglichen. Oft werden diese Verfahren an den Zehengrundgelenken eingesetzt.
Arthrodese (Gelenkversteifung)
Das erkrankte Gelenk wird entfernt, die Knochenstümpfe werden in einer für die Funktion günstigen Stellung aufeinander fixiert. Sind wenige Gelenke betroffen, wird dieses Vorgehen an den Fingern eingesetzt.
Arthroplastik
Ein Teil des Gelenkes wird reseziert, der entstandene Defekt mit körpereigenem Gewebe aufgefüllt. Meistens wird hierzu eine eingerollte Sehne verwendet. Sinnvoll kann dieses Vorgehen im Bereich der Handwurzel sein.
Endoprothesen
Während bei Arthrosen versucht wird, den Einbau eines künstlichen Gelenkes so lange wie möglich hinaus zu zögern, wird bei rheumatischen Erkrankungen die Entscheidung für eine Gelenkprothese oft schon bei relativ jungen Leuten gestellt. Das Ziel liegt hierbei in einer Entlastung anderer Gelenke dadurch, dass das mit einer Prothese versorgte Gelenk, etwa ein Knie oder eine Hüfte, schmerzfrei funktioniert. Der Verfall der anderen Gelenke wird dadurch verzögert. Gerade bei Rheumatikern sind diese Operationen allerdings oft mit Schwierigkeiten behaftet, Grunderkrankung und Nebenwirkungen der eingesetzten Basistherapeutika bedingen einen sehr wenig haltbaren, spröden Knochen, der mechanische Halt der Prothese ist schlecht, es droht die frühe Ablockerung.
Radiosynoviorthese
Eine Alternative zur operativen Behandlung stellt die Radiosynoviorthese (RSO) dar. Die Wirksamkeit bei der rheumatoiden Arthritis ist durch Studien mit hohem Evidenzgrad gesichert. Die Indikation zur RSO ist gegeben, wenn nach sechsmonatiger Basistherapie auch durch intraartikuläre Injektion von cortisonhaltigen Lösungen der Krankheitsprozess nicht zu beherrschen ist. Die Erfolge der RSO sind umso besser, je früher sie im Krankheitsgeschehen eingesetzt wird. Als absolute Kontraindikationen gelten Schwangerschaft und Stillzeit, als relative Kontraindikationen die Behandlung bei Kindern und Jugendlichen. Die verwendeten Nuklide (vor allem 90Y, 186Re und 169Er) richten sich nach der Größe des zu behandelnden Gelenks. Es handelt sich um reine oder zumindest vorwiegende Beta-Strahler.[4]
Einzelnachweise
- ↑ a b H. G. Fassbender: Pathology and Pathobiology of Rheumatic Diseases. Heidelberg: Springer, 2002. ISBN 978-3-540-62942-9.
- ↑ H. G. Fassbender: Rheumatoide Arthritis. In: Spezielle pathologische Anatomie Bd. 18 Pathologie der Gelenk und Weichteiltumoren, ed. W. Doerr, G. Seifert. Berlin/Heidelberg: Springer, 1984. 191-229.
- ↑ H. G. Fassbender: Normal and pathological synovial tissue with emphasis on rheumatoid arthritis In: Rheumatology and Immunology, 2nd Ed. (ed. A.S. Cohen and J.C. Bennett), Orlando-New York: Grüne & Stratton, 1986, 36-42. ISBN 978-0-8089-1809-7
- ↑ G. Mödder. Radiosynoviorthese. In: T. Kuwert, F. Grünwald, U. Haberkorn, T. Krause. Nuklearmedizin. Stuttgart, New York 2008 ISBN 978-3-13-118504-4
Weblinks
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.