- Autoimmun
-
Autoimmunerkrankung ist in der Medizin ein Überbegriff für Krankheiten, deren Ursache eine überschießende Reaktion des Immunsystems gegen körpereigenes Gewebe ist. Irrtümlicherweise erkennt das Immunsystem körpereigenes Gewebe als zu bekämpfenden Fremdkörper. Dadurch kommt es zu schweren Entzündungsreaktionen, die zu Schäden an den betroffenen Organen führen.
Inhaltsverzeichnis
Definition
Das Immunsystem ist für die Erkennung und Abwehr von Fremdstoffen, Mikroorganismen und Viren verantwortlich; eine wichtige Rolle spielen T-Zellen, die im Thymus „geschult“ werden, nur an die eigenen MHC-Moleküle anzudocken und dabei körpereigene Strukturen zu tolerieren. Dieser Prozess wird als „klonale Deletion“ bezeichnet; bei der ersten Selektion im Thymus überleben nur diejenigen T-Zellen, die MHC-Moleküle auf den körpereigenen Zellmembranen erkennen können, die Bindung jedoch nicht so fest ist, dass sie zur Aktivierung der T-Zellen führen könnte. T-Zellen, die eigene MHC-Moleküle gar nicht binden (also erkennen) können, werden eliminiert. Bei der ebenfalls im Thymus stattfindenden klonalen Deletion werden diejenigen T-Zellen eliminiert, die körpereigene MHC-Moleküle derart „zielsicher“ erkennen und fest binden können, dass sie aktiviert würden – was letztlich zur Zerstörung körpereigener Zellen führen würde. Dieses Prozedere ist eine derjenigen Maßnahmen, die das Immunsystem ergreift, um „sich selbst“ zu schonen und „Fremdes“ bekämpfen zu können.
Bei Autoimmunkrankheiten verhält sich eine Gruppe der T-Zellen abweichend. Neben der immer noch funktionierenden Abwehr von Fremdmolekülen und -organismen greifen sie nun ebenfalls körpereigene Strukturen an. Organe oder Gewebe werden als fremd erkannt, und die Folgen können schwerwiegend sein. Wenn lebensnotwendige Strukturen betroffen sind, kann eine Autoimmunkrankheit tödlich verlaufen. Das Immunsystem richtet seine Abwehr gegen die als fremd erkannten körpereigenen Gewebe (zelluläre wie auch humorale Abwehrreaktionen; Autoantikörper werden gebildet), was zur Folge hat, dass betroffene Organe im Laufe der Zeit ihre Funktion aufgeben müssen. Zumeist wird das Immunsystem geschwächt, und der Körper wird anfällig für allerlei Krankheiten. Unter Umständen ist auch die Fremderkennung gestört, wodurch die Ausbreitung entarteter Krebszellen nicht mehr effektiv unterbunden werden kann, und die Betroffenen werden infolgedessen anfälliger für Infektionskrankheiten. Im Verlauf der Erkrankungen zerstören Zellen des Immunsystems die körpereigenen Strukturen, während Reparatur-Mechanismen des Körpers nach Möglichkeit versuchen, die geschädigten Organteile zu erneuern. Dieser irrtümliche Angriff des Abwehrsystems setzt sich ohne Behandlung in der Regel lebenslang oder bis zur vollständigen Zerstörung der Zielstruktur fort.
MHC-Moleküle
Unser Organismus kann zwischen eigenen und körperfremden Eiweißmolekülen (etwa von Bakterien, Viren oder Würmern) unterscheiden; der Körper muss daher über Selbsterkennungsproteine verfügen. Für die Unterscheidung entscheidend sind die MHC-Proteine (engl. Major Histocompatibility Complex). Mit Hilfe dieser Membranproteine erkennt das Immunsystem körperfremde Zellen. Es gibt zwei Typen von MHC-Proteinen, Proteine der Klasse I (HLA-Klasse-I-Moleküle) kommen auf allen kernhaltigen Zellen des Körpers vor. MHC-Moleküle der Klasse II (HLA-Klasse-II-Moleküle) kommen dagegen ausschließlich auf der Oberfläche von Antigen-präsentierenden Zellen (etwa Makrophagen) vor.
Die Klasse I und II MHC-Moleküle werden von 13 oder 14 Genen codiert, die mit Ausnahme von β2-Mikroglobulin alle im HLA-Locus auf Chromosom 6 liegen. Diese Gene sind polymorph, das heißt, dass auf Populationsebene eine große Anzahl an verschiedenen Allelen existiert. Daher besitzen zwei weitläufig verwandte Menschen nur selten den gleichen Satz von MHC-Proteinen. Da die MHC-Proteine auf der Oberfläche fast aller Zellen (Erythrozyten ausgenommen) anzutreffen sind, sind sie charakteristisch für die Oberflächenstruktur. Im menschlichen Organismus wird die Oberflächenstruktur als Ausweis angesehen (T-Zellen überprüfen die Zelloberflächen von anderen Zellen, um zu erkennen, ob diese Zellen körperfremd sind). Probleme treten auf, wenn die Oberflächen dieser Zellen verändert sind. Bei Organtransplantationen stellt dieser Aspekt ein großes Problem dar, weil in vielen Fällen die transplantierten Organe vom Körper abgestoßen werden. Bei Nieren- und Knochenmarktransplantationen wird daher versucht, Spender-Empfänger-Paare zu finden, die mit den Oberflächenstrukturen des Organempfängers weitestgehend zusammenpassen.
Immuntoleranz
Der erste Forscher, der den Unterschied zwischen „selbst“ und „fremd“ erkannte, war der deutsche Mikrobiologe Paul Ehrlich. Er wollte ursprünglich um 1900 herausfinden, was mit Blut, das nach inneren Blutungen zurückbleibt, geschieht. Daher startete er einen Versuch, indem er Ziegen Schafsblut injizierte. Das Erstaunliche war, dass das Immunsystem die fremden Blutzellen (Erythrozyten) sogleich vernichtete.
Als Ehrlich später den Versuch mit artgleichen Tieren durchführte, geschah dasselbe. Das Immunsystem wehrte sich gegen die fremden Blutzellen.
Erst als er eine Ziege mit ihrem eigenen Blut behandelte, erkannte Ehrlich, dass der Körper erkennt, was körperfremd und körpereigen ist. Die Ziege zerstörte bei diesem Versuch die injizierten Blutzellen nicht (obwohl Ehrlich das Blut eine gewisse Zeit aufbewahrte). Ehrlich stellte in Folge dieser Experimente das biologische Prinzip der Horror autotoxicus (Furcht vor Selbstzerstörung) auf. Obwohl dieses Prinzip äußerst simpel klingt, ist es dennoch lebensnotwendig für alle Lebewesen. Würde die Ziege ihr eigenes Blut abbauen, würde sie schon bei geringsten Verletzungen sterben (wenn ihr Immunsystem ihr eigenes Blut angreifen würde). Doch dieser Selbstschutz ist nicht immer von Vorteil. Körpereigene Krebszellen werden daher vor ihrer Zerstörung bewahrt. Denn der Körper greift sich im Normalfall nicht selbst an. Doch in der heutigen Medizin ist seit Neuestem bekannt, dass Krebszellen ebenso wie Antigene vom Immunsystem angegriffen werden, wenn sie sich nur deutlich genug von Nicht-Krebszellen (gesunden Zellen) unterscheiden. Dass es dennoch dazu kommt, dass der eigene Körper im Falle einer Autoimmunkrankheit seine Organe als fremd ansieht und angreift, ist ein Problem mit dem die Forscher und Mediziner weiterhin konfrontiert sind.
Entstehung
Die genaue Ursache von Autoimmunerkrankungen ist trotz intensiver Forschung weiterhin unklar. Anerkannte Hypothesen gehen davon aus, dass Autoimmunkrankheiten durch angeborene „Empfänglichkeit“ (Genetische Disposition; etwa durch das Vorhandensein bestimmter MHC-Molekül-Varianten) in Kombination mit äußeren Einflüssen erworben werden. Gibt es im Körper des Betroffenen solche genetisch bedingte Faktoren und es kommen darüber hinaus ungünstige Umweltfaktoren wie starker Stress, Infektionen, Schwangerschaft hinzu, kann es zum Ausbruch von Autoimmunerkrankungen kommen. („Bad luck and bad genes“: ungefähr: „Pech und falsche Gene“) Die Zielstrukturen der Autoimmunreaktion kann sich auf ein bestimmtes Organ (von der Haarwurzel bis zur Leber) beschränken oder den ganzen Körper (mehrere Organe und Gefäßsystem) befallen. Mischformen mit mehreren Autoimmunerkrankungen sind nicht selten.
Autoantikörper
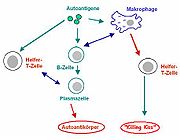
Treffen auf einen Menschen die oben genannten Faktoren (erbliche Empfänglichkeit sowie ungünstige Umwelteinflüsse, etwa eine virale Infektion) zu, dann entsteht eine Autoimmunerkrankung. Autoantigene, wie etwa Reste von Zellmembranen (als Membranvesikel oder Mizellen), DNA-Fragmente oder körpereigene Proteine schwimmen im Blutstrom durch den Körper. T-Lymphozyten und andere Immunzellen erkennen nun diese Antigene fälschlicherweise als fremd. Wie bei einer natürlichen Abwehrreaktion schaltet sich nach der Erkennung der „Fremdkörper“ die Immunantwort ein. Entzündungsfördernde Stoffe (bestimmte Zytokine) werden ausgeschüttet und somit die Zell-Zell-Kommunikation gefördert. Immer mehr Immunzellen werden angelockt, und die falschen Informationen werden weitergeleitet. B-Lymphozyten differenzieren sich zu Plasmazellen und beginnen mit der Produktion von Autoantikörpern (Autosensibilisierung), die ins Blut abgegeben werden. Mit dem Blut gelangen sie in den gesamten Körper und binden sich an ihre spezifischen Antigene (etwa Zellwände). Dort lagern sich die Antikörper an die Zielstrukturen der Autoimmunreaktion an und markieren diese Zellen für Fresszellen und CD8 T-Zellen als zu beseitigende. Das führt zur Schädigung des betroffenen Organs. Auf dieselbe Weise können diese Antikörper an Nervenzellen andocken und wie etwa bei Multiple Sklerose zu Störungen führen, die für die Hirnregion spezifisch sind.
Neben dem Faktor des Verlustes der Immuntoleranz könnte auch ein Erreger den Ausbruch einer Autoimmunkrankheit verursachen. Dieser Erreger müsste eine hohe Ähnlichkeit mit der Struktur eines körpereigenen Gewebes haben (viele Erreger versuchen den Körper durch ihre Oberfläche zu täuschen, damit sie ungehindert in den Körper gelangen können; dieser Täuschungsversuch wird als molekulares Mimikry bezeichnet). Nach dem Erkennen des Erregers wird die Immunabwehr diesen bekämpfen (Autoantikörper werden gebildet und Immunzellen greifen dabei auch eigene Gewebsstrukturen an). Nach der initialen Immunreaktion verbleiben Gedächtniszellen permanent im Körper, die nach diesem Erreger „suchen“, was zur Autoimmunkrankheit führen könnte (spezifische Gedächtniszellen stoßen auf das betreffende Gewebe und verursachen Abwehrreaktionen). Ein bekanntes Beispiel ist das so genannte Rheumatische Fieber, ein Infekt durch Streptokokken (genauer β-hämolysierenden Streptokokken). Die Antikörper, die gegen diesen Erreger gebildet werden, können das Gewebe des Herzmuskels angreifen, wenn man genetisch anfällig für Autoimmunkrankheiten ist.
Ausschlaggebend ist jeweils die Höhe der vorhandenen serologischen Autoantikörpertiter als Kriterium für die Diagnose einer Autoimmunerkrankung, denn Autoantikörper sind meist physiologisch (beispielsweise ANA, dsDNA-Antikörper und Anti-Phospholipid-Antikörper). Ein Überschreiten eines gegebenen Titers gilt dann als pathologisch. Manche Autoantikörper sind nicht physiologisch und von vornherein als pathologisch zu werten (beispielsweise ANCA und Endomysiale Antikörper) Ferner sind erhöhte oder vorhandene Autoantikörpertiter nicht zwingend notwendig für die Diagnose einer Autoimmunerkrankung, da eine Autoimmunerkrankung anhand von serologischen und klinischen Kriterien gestellt wird. Alleine erhöhte oder vorhandene pathologische Autoantikörpertiter reichen für eine Diagnose nicht aus, da diese anhand eines Scores (Erreichen einer gewissen Punktezahl) gestellt wird.
Therapie
Da die Ursachen von Autoimmunerkrankungen nicht bekannt sind, ist keine kausale Therapie möglich. Autoimmunerkrankungen können daher nur symptomatisch behandelt werden (entzündungshemmend, beziehungsweise immunsupprimierend). Autoimmunerkrankungen werden je nach betroffenem Organ von den jeweiligen Fachärzten, etwa Internisten, Dermatologen, Neurologen, Endokrinologen oder Nuklearmedizinern behandelt. Grundprinzip der symptomatischen Therapie ist hierbei, die Aktivität des Immunsystems durch Gabe von Immunsuppressiva, etwa Cortison, zu dämpfen. Aufgrund der mannigfaltigen systemischen Neben- und Wechselwirkungen dieser Substanzen wurde versucht, neue Medikamente zu entwickeln, die spezifisch die am Krankheitsgeschehen beteiligten Mechanismen beeinflussen. Beispiele hierfür sind Natalizumab und Infliximab, die zur Therapie der Multiplen Sklerose oder der Rheumatoiden Arthritis eingesetzt werden. Obwohl diese neueren Substanzen spezifisch wirken und von den meisten Patienten gut vertragen werden, kann es in seltenen Fällen zu schweren Nebenwirkungen kommen (etwa progressive multifokale Leukenzephalopathie (PML) unter Natalizumab).
Klassifikation von Autoimmunerkrankungen
Heutzutage sind etwa 60 Autoimmunkrankheiten bekannt, und das Spektrum der erkrankten Organe ist groß.
Man kann diese Krankheiten in drei Gruppen aufteilen:
- Organspezifische Krankheiten: Zu ihnen zählen Krankheiten, bei denen spezifische Organe (Gewebsstrukturen) vom Immunsystem angegriffen werden.
- Systemische Krankheiten oder nicht-organspezifische Krankheiten: Systemisch-entzündliche rheumatische Erkrankungen wie Kollagenosen, die fünf bis zehn Prozent der Erkrankungen des rheumatischen Formenkreises ausmachen, gehören in diese Gruppe. Typische Autoantikörper sind hier die Antinukleären Antikörper (ANA), die gegen Strukturen des Zellkerns, teilweise aber auch des Zytoplasmas gerichtet sind.
- Intermediäre Krankheiten: Sie sind Mischformen oder Übergangsformen. Eine breite Immunantwort wird bei diesem Krankheitstyp ausgelöst.
Literatur
- Stefan Dübel, Petra Rohrbach, Andreas Schmiedl (2004): Rekombinante Antikörper: Werkzeuge gegen Krebs, Infektionen und Autoimmunerkrankungen? In: Biologie in unserer Zeit. Bd. 34, Nr. 6, S. 372–379. doi:10.1002/biuz.200410267 PDF
- Charles A. Janeway, Paul Travers, Mark Walport: Immunologie, 5. Auflage, Spektrum Akademischer Verlag, 2002.
Siehe auch
Weblinks
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.