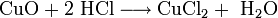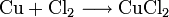- CuCl2
-
Kristallstruktur 
Kristallsystem monoklin (CuCl2, wasserfrei)[1] Raumgruppe 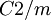
Gitterkonstanten a = 690 pm
b = 330 pm; β = 122.20°
c = 682 pmKoordinationszahlen Cu[6], Cl[3] Allgemeines Name Kupfer(II)-chlorid Andere Namen - Kupferchlorid
- Kupfer(II)-chlorid Dihydrat (CuCl2 · 2 H2O)
Verhältnisformel CuCl2
CuCl2 · 2 H2O (Dihydrat)CAS-Nummer - 7447-39-4
- 10125-13-0 (Dihydrat)
Kurzbeschreibung braunes Pulver [2]
blau-grünes Pulver (Dihydrat) [3]Eigenschaften Molare Masse 134,45 g·mol−1
170,48 g·mol−1 (Dihydrat)Aggregatzustand fest
Dichte Schmelzpunkt 498 °C (wasserfrei)
Siedepunkt 993 °C (wasserfrei)
Löslichkeit 422 g/l (20 °C) in Wasser [2]
680 g/l (15 °C) in Methanol
530 g/l (15 °C) in EthanolSicherheitshinweise Gefahrstoffkennzeichnung [2] 

Gesundheits-
schädlichUmwelt-
gefährlich(Xn) (N) R- und S-Sätze R: 22-36/38-50/53 S: 22-26-61 MAK 0,1 mg·m−3 [2]
Thermodynamische Eigenschaften ΔHf0 −220 kJ·mol−1
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kupfer(II)-chlorid ist eine chemische Verbindung und ein Kupfer-Salz der Salzsäure mit der Formel CuCl2. Kristallwasserfreies Kupfer(II)-chlorid ist ein braunes Pulver, welches stark hygroskopisch ist. Durch den Einbau von Wassermolekülen in seine Kristallstruktur entsteht das Kupfer(II)-chlorid Dihydrat, ein blau-grüner Feststoff mit der Formel CuCl2 · 2 H2O. Das kristallwasserfreie Kupferchlorid zerfließt an feuchter Luft zu einem braunen Brei, während das Dihydrat an Luft stabil ist. Durch Erhitzen auf über 100 °C wird aus dem Dihydrat das Kristallwasser ausgetrieben und die braune, wasserfreie Form bleibt zurück. Beide Verbindungen zeigen in einer Brennerflamme eine blaugrüne Flammenfärbung, hervorgerufen durch die Cu2+-Ionen.
Inhaltsverzeichnis
Vorkommen
Kupfer(II)-chlorid kommt in der Natur als Mineral Tholbachit vor, das Dihydrat ist auch als Mineral Eriochalcit bekannt. Beide Verbindungen sind oft auch mit dem Kupfererz Atacamit vergesellschaftet.
Gewinnung und Darstellung
Im Labor kann man Kupfer(II)-chlorid aus Kupfer(II)-oxid und Salzsäure herstellen:
Technisch wird es durch Chlorierung von Kupferblech gewonnen.
Eigenschaften
Wasserfreies Kupfer(II)-chlorid tritt in der Form eines braunen bis gelben Pulvers auf; das Dihydrat ist türkisfarben. Beide erzeugen aufgrund der enthaltenen Kupferionen (Cu2+) eine grüne Flammenfärbung.
Das wasserfreie Kupfer(II)-chlorid kristallisiert im monoklinen Kristallsystem mit der Raumgruppe C2/m in einer verzerrten CdI2-Struktur. Die Verzerrung der Struktur wird durch den Jahn-Teller-Effekt hervorgerufen, der durch die Valenzelektronenkonfiguration (d9) der Cu2+-Ionen entsteht. Das wasserfreie Kupfer(II)-chlorid war die erste Verbindung, in der ein Koordinationspolyeder in Form eines (verzerrten) Oktaeders aus sechs Chlorid-Anionen um ein Cu2+-Ion nachgewiesen werden konnte.[1]
Das Kupfer(II)-chlorid Dihydrat hingegen kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe Pbmn. Die Cu2+-Ion werden hier von vier Cl−-Ionen quadratisch-planar umgeben, die zwei verbleibenden Ecken des verzerrten Oktaeders sind durch die Wassermoleküle besetzt.[4]
Verwendung
Kupferchlorid wird als Katalysator bei organischen Synthesen, z. B. bei der Herstellung des Textilfarbstoffes Anilinschwarz und der Oxychlorierung genutzt. Außerdem nutzt man es in der Pyrotechnik zur Erzeugung von grünen Flammen, bei der Kupferätzung (in einer Mischung mit Salzsäure), in der Fotografie zum Ausbleichen von Negativen und zum Entrußen von Ölöfen.
Nachweis
Kupfer(II)chlorid wird mit Ammoniakwasser nachgewiesen. Hierbei fällt blaues Kupfer(II)hydroxid aus welches sich bei weiterer zugabe wieder als Tetramminkupfer löst.
Quellen
- ↑ a b P. C. Burns, F. C. Hawthorne: "Tolbachite, CuCl2, the first example of Cu2+ octahedrally coordinated by Cl−", American Mineralogist 1993, Nr. 78, S. 187–189.
- ↑ a b c d e Eintrag zu CAS-Nr. 7447-39-4 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 9. Dezember 2007 (JavaScript erforderlich)
- ↑ a b Eintrag zu CAS-Nr. 10125-13-0 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 9. Dezember 2007 (JavaScript erforderlich)
- ↑ S. Brownstein, N. F. Han, E. J. Gabe, Y. le Page: "A redetermination of the crystal structure of cupric chloride dihydrate", Zeitschrift für Kristallographie 1989, Nr. 189, S. 13–15.
Weblinks
Wikimedia Foundation.

_chloride.jpg)
_chloride_dihydrate.jpg)