- E503i
-
Strukturformel 
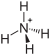
![\mathrm{ \ \!\ \Biggr]_2}](/pictures/dewiki/48/07a3843eb4b51c9bed598e32e34f28db.png)

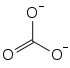
![\mathrm{ \ \!\ \Biggr]}](/pictures/dewiki/50/2c6110b020ae0c3cfe64f3748f9aea9a.png)
Allgemeines Name Ammoniumcarbonat Andere Namen - kohlensaures Ammonium
- Hirschhornsalz
Summenformel (NH4)2CO3 CAS-Nummer 10361-29-2 Kurzbeschreibung farbloser Feststoff Eigenschaften Molare Masse 96,09 g·mol-1 Aggregatzustand fest
Dichte 1,6 g·cm-3
Schmelzpunkt Siedepunkt Zersetzung
Dampfdruck Löslichkeit gut in Wasser (320 g/l)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22 S: keine S-Sätze LD50 1975 mg/kg (oral, Ratte)[1]
WGK 1[1] Thermodynamische Eigenschaften ΔHf0 −942 kJ·mol−1[2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Ammoniumcarbonat, (NH4)2CO3 · H2O, bildet wasserlösliche, farblose, kubische Kristalle mit einer relativen Molekülmasse Mr von 114,10. Es zerfällt bei 58 °C vollständig in Ammoniak, Kohlenstoffdioxid und Wasser.
Inhaltsverzeichnis
Eigenschaften
Das Salz bildet ein farbloses, schwach nach Ammoniak riechendes Pulver. Es hat eine Dichte um 1,6 g·cm-3 (bei 20 °C) und eine hohe Wasserlöslichkeit von ca. 220 g/L. Die Lösung reagiert schwach basisch, es stellt sich ein Gleichgewicht zwischen Ammoniak NH3, Ammoniumionen NH4+, Carbonationen CO32-, Hydrogencarbonationen HCO3- und Kohlenstoffdioxid CO2 ein.
Das Salz reagiert also mit Wasser und Kohlensäure zu Hydrogencarbonat- und Hydroxidionen. Eine wässrige Lösung von Ammoniumcarbonat ist daher nur im neutralen und schwach basischen Milieu beständig - in Säuren entweicht Kohlenstoffdioxidgas, in konzentrierten Laugen Ammoniakgas.
Synthese
Die Darstellung von Ammoniumcarbonat kann durch Umsetzung von Kohlenstoffdioxid mit Ammoniak in wässriger Lösung erfolgen.
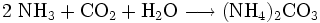
Eine weitere Darstellungsmöglichkeit ergibt sich durch Erhitzen von Calciumcarbonat zusammen mit Ammoniumsulfat.

Bei letzterer Methode sublimiert neben dem gewünschten Ammoniumcarbonat auch noch Ammoniumhydrogencarbonat und Ammoniumcarbamat ab, als Feststoff bleibt Calciumsulfat zurück.
Verwendung
Ammoniumcarbonat wird in der Synthese von Heterocyclen und als Zusatzstoff von fotografischen Entwicklern eingesetzt. Ebenso findet es in der Färberei, als Kohlendioxid-Entwickler in Löschgeräten und als Riechsalz Verwendung.
Zudem wird es als Backtriebmittel (als Bestandteil von Hirschhornsalz) genutzt. In der EU ist es als Lebensmittelzusatzstoff der Nummer E 503i zugelassen.
Ammoniumcarbonat wird häufig in der Anorganischen Chemie für eine Qualitative Analyse verwendet, um im Kationentrenngang aus einer unbekannten Probe die Erdalkalimetallkationen von Barium, Strontium und Calcium als eine Gruppe auszufällen, aufzutrennen und mit Hilfe von Nachweisreaktionen zu identifizieren.
Einzelnachweise
Wikimedia Foundation.
