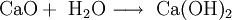- E 526
-
Kristallstruktur 
__ Ca2+ __ OH− Allgemeines Name Calciumhydroxid Andere Namen - Calciumdihydroxid
- Calciumlauge
- Portlandit
- Kalkwasser (als wässrige Lösung)
- gelöschter Kalk
- Marmorkalkhydrat
- Ätzkalk
Verhältnisformel Ca(OH)2 CAS-Nummer 1305-62-0 Kurzbeschreibung weißes Pulver Eigenschaften Molare Masse 74,10 g·mol−1 Aggregatzustand fest
Dichte Schmelzpunkt Löslichkeit nahezu nicht in Wasser (1,7 g·l−1 bei 20 °C[1], 0,77 g·l−1 bei 100 °C), nicht in Ethanol
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 41 S: 22-24-26-39 LD50 7340 mg·kg−1 (Ratte, oral)[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Calciumhydroxid (auch: Kalziumhydroxid, gelöschter Kalk, Löschkalk, Kalkhydrat, Portlandit) ist das Hydroxid des Calciums.
Gemenge mit mehr als 95 % CaO nennt man Weißkalk.
Inhaltsverzeichnis
Eigenschaften
Calciumhydroxid Ca(OH)2 ist ein weißes, ätzendes Pulver, welches sich nur schlecht (etwa 1,7 g/l) in Wasser löst.
Gebrannter (ungelöschter) Kalk (Calciumoxid, Branntkalk) und gelöschter Kalk sind stark ätzend (pH-Wert 12–13), Kontakt mit den Augen kann zur Erblindung führen!
Herstellung
Calciumhydroxid entsteht unter starker Wärmeentwicklung (exotherme Reaktion) beim Versetzen von Calciumoxid mit Wasser. Diesen Vorgang nennt man auch Kalklöschen. Die Wärmeentwicklung ist so stark, dass Teile des Wassers verdampfen (umgangssprachlich als „Rauchen“ bezeichnet).
Einen Überblick über die Umwandlungsprozesse zwischen verschiedenen Calciumverbindungen (Technischer Kalkkreislauf) gibt folgendes Schaubild:
Verwendung
Suspensionen in Wasser sind:
- Fettkalk (Sumpfkalk): eine cremig-steife Masse – Baustoff: Kalkmörtel
- Kalkmilch: eine weißliche, milchartige Flüssigkeit, die sich aber entmischt – Kalkfarbe, Neutralisation von Säuren, Entcarbonisierung, Rauchgasentschwefelung
Kalkwasser ist die (nahezu) gesättigte Lösung von Calciumhydroxid und dient als klare Flüssigkeit dem Nachweis von Kohlenstoffdioxid.
Calciumhydroxid ist ein Zwischenprodukt zur Herstellung von Chlorkalk.
Weiterhin wird es als Medikament in der Zahnmedizin verwendet. Im Bauwesen findet Calciumhydroxid unter dem Namen Weißkalkhydrat Verwendung (DIN 1060). Kalkputze bestehen aus Mischungen von Calciumhydroxid, gemahlenem Kalkstein und Sand.
Calciumhydroxid ist auch Bestandteil des Atemkalks, welche in Narkosegeräten oder Tauchgeräten mit Rückatmung zum Herausfiltern von Kohlenstoffdioxid aus der Ausatemluft verwendet wird.
Der gelöschte Kalk wird unter anderem als Alternative zum Kalkstein in der Rauchgasentschwefelung eingesetzt. Die Einsatzmenge ist hierbei ca. 1,8-fach geringer als für Kalkstein. Der dabei gewonnene Gips (Calciumsulfat) hat einen Weißgrad von 80 % und kann kommerziell weiterverwendet werden. Durch seine hohe Reaktivität werden geringere Verbrauchmengen benötigt. Nachteil ist sein deutlich höherer Preis gegenüber Kalkstein.
Eine weitere Verwendung findet Calciumhydroxid als Pflanzenschutzmittel im Obstbau. Hier wird es zum Beispiel als Fungizid (Pilzgift) gegen Obstbaumkrebs eingesetzt.
Die ätzende Wirkung, welche auch diverse Krankheitserreger zerstört, ist der Grund, warum früher gelöschter Kalk zum Desinfizieren von Ställen (das „Kalken“ der Ställe) benutzt wurde.
Es wird in der Lebensmittelindustrie als Säureregulator Lebensmitteln zugesetzt. Es ist in der EU als Lebensmittelzusatzstoff der Bezeichnung E 526 ohne Höchstmengenbeschränkung (quantum satis) für Lebensmittel allgemein zugelassen.
Kalk wird auch zur Verbesserung der Tragfähigkeit von Baugrund eingesetzt. Ein Boden mit zu hohem Wassergehalt und daraus resultierender geringer Tragfähigkeit, schlechter Verdichtbarkeit kann durch das Untermischen von 2–4 % MA Kalk verbessert werden. Der Kalk bindet einen Teil des Wassers und verbessert so unter anderem die Plastizität, die Verdichtbarkeit und die Tragfähigkeit. Deshalb ist die Bodenverbesserung mit Kalk ein Verfahren zur sofort erreichbaren Verbesserung der Einbaufähigkeit und Erleichterung der Ausführung von Bauarbeiten.
Quellen
Wikimedia Foundation.