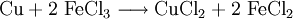- Eisen(III)chlorid
-
Kristallstruktur -chloride-vdW-3D-balls.png)
__ Fe3+ __ Cl− Allgemeines Name Eisen(III)-chlorid Andere Namen - Eisentrichlorid
- Ferrichlorid
Verhältnisformel FeCl3 CAS-Nummer 7705-08-0 Kurzbeschreibung schwarz bis dunkelgrau, als Hexahydrat gelb Eigenschaften Molare Masse 162,21 g·mol−1 Aggregatzustand fest
Dichte 2,898 g·cm−3[1]
Siedepunkt > 120 °C (Sublimation)[1]
Dampfdruck Löslichkeit in Wasser: 920 g·l−1 (20 ºC)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22-38-41 S: 26-39 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Eisen(III)-chlorid ist eine chemische Verbindung von Eisen(III)- und Chloridionen. Die römische Ziffer III gibt die Oxidationszahl des Eisenions (in diesem Fall +3) an. Eisen(III)-chlorid gehört zur Gruppe der Eisenhalogenide.
Unter die Bezeichnung Eisenchlorid fällt auch die Verbindung Eisen(II)-chlorid (FeCl2).
Inhaltsverzeichnis
Gewinnung und Darstellung
Wasserfreies Eisen(III)-chlorid erhält man im Labor, indem man Chlor bei Temperaturen von 250 °C bis 400 °C über Eisendraht, -wolle oder ähnliches leitet. Anschließend wird das Produkt zur Reinigung im Chlorstrom bei 220 °C bis maximal 300 °C sublimiert. Dabei ist darauf zu achten, dass sowohl die eingesetzten Geräte als auch die Chemikalien möglichst wasserfrei sind.
Das kristallwasserhaltige Eisenchlorid kann auch durch Auflösen von Eisenpulver in Salzsäure
und das nachfolgende Einleiten von Chlor hergestellt werden, wobei das zunächst entstandene Eisen(II)-chlorid in Eisen(III)-chlorid übergeht:
Dieses kann anschließend durch Eindampfen der Lösung gewonnen werden.
Zur technischen Produktion leitet man Chlor bei etwa 650 °C über Eisenschrott.
Wasserfreies Eisen(III)-chlorid wird zum Schutz vor Wasser unter Schutzgas (z. B. Stickstoff) unter Luftabschluss gelagert.
Eigenschaften
Wasserfreies Eisen(III)-chlorid ist eine schwarze, leicht stechend nach Salzsäure riechende Substanz. Als wasserfreie Verbindung ist es extrem hygroskopisch, zieht also an der Luft Wasser an. Mit steigendem Wassergehalt nimmt die hygroskopische Natur ab und die Farbe verändert sich über rot-bräunlich bis hin zu gelblich, es entsteht Eisen(III)-chlorid-Hexahydrat (FeCl3 · 6 H2O). Dieses reagiert durch Hydrolyse stark sauer. Beim Erhitzen zersetzt sich das Hydrat unter Abspaltung von Wasser und Chlorwasserstoff; es ist also auf diesem Weg nicht möglich, daraus wieder wasserfreies Eisen(III)-chlorid zu erhalten.
Eisen(III)-chlorid ist eine vorwiegend kovalente Verbindung mit Schichtstruktur. Oberhalb des Sublimationspunkts liegt sie vor allem als gasförmiges Fe2Cl6 vor, das mit steigender Temperatur zunehmend zu FeCl3 dissoziiert. Wasserfreies Eisen(III)-chlorid verhält sich chemisch ähnlich wie wasserfreies Aluminiumchlorid. Genau wie dieses ist es eine mäßig starke Lewis-Säure.
Eisen(III)-chlorid kann Kupfer oxidieren und lösen; deshalb kann man wässrige Eisen(III)-chlorid-Lösungen zum schonenden Ätzen von Leiterplatten verwenden:
Verwendung
Eisen(III)-chlorid wird zur Bindung von Schwefelwasserstoff, zur Phosphatfällung und allgemein bei der biologischen Abwasserreinigung als Flockungsmittel eingesetzt. Durch Zusatz von Kaliumhexacyanoferrat(II) kann der Farbstoff Berliner Blau erzeugt werden (s. u.). Als Lösung mit Wasser wird es beim Textildruck als Oxidationsmittel und Farbbeize eingesetzt, in der Medizin als blutstillendes Mittel (Hämostyptikum bzw. Adstringens, in Deutschland nicht mehr im Handel), zum Ätzen von Metallen (z. B. beim Kupfertiefdruck) und von Platinen bei gedruckten Schaltungen und bei der Herstellung von Farbstoffen (Anilinschwarz). In der chemischen Industrie wird es als selektiv wirkender Katalysator bei vielen Friedel-Crafts-Reaktionen eingesetzt. Eisen(III)-chlorid ist weiterhin Fällmittel bei der Simultanfällung. Viele Phenole ergeben mit Eisen(III)-chlorid grün oder blau gefärbte Komplexe und können so nachgewiesen.
Sicherheitshinweise
Eisen(III)-chlorid ist gesundheitsschädlich beim Verschlucken und reizt die Haut. Es besteht die Gefahr ernster Augenschäden. In Verbindung mit Alkalimetallen besteht Explosionsgefahr.
Toxizität
Die LD50 bei Ratten beträgt bei oraler Applikation 450 mg·kg−1.
Nachweis
über Fe3+-Ionen
Gibt man zu Eisen(III)-chloridlösung Kaliumhexacyanoferrat(II), entsteht ein tiefblauer Niederschlag des Pigments Berliner Blau:
![\mathrm{Fe^{3+}_{(aq)} + [Fe(CN)_6]^{4-}_{(aq)} + K^+_{(aq)} \longrightarrow KFe^{III}[Fe^{II}(CN)_6]_{(s)}}](/pictures/dewiki/98/bc5d34e63b82c32b104d99fe8fb123d2.png) .
.
Ein weiterer sehr empfindlicher Nachweis geschieht mittels Thiocyanat-Ionen (SCN-):
![\mathrm{[Fe(H_2O)_6]^{3+}_{(aq)} + SCN^-_{(aq)} \longrightarrow [Fe(SCN)(H_2O)_5]^{2+}_{(aq)} + H_2O}](/pictures/dewiki/49/11cb2b04615bcb9308a433e524a251bb.png) .
.
Die gebildeten komplexen Pentaaquathiocyanatoeisen(III)-Ionen erscheinen intensiv rot.
Ein weiterer Nachweis wäre der rot-braune Niederschlag von Eisen(III)oxidhydrat ("Eisen(III)-hydroxid"), der bei Reaktion mit OH--Ionen entsteht.
Quellen
- ↑ a b c d e Eintrag zu CAS-Nr. 7705-08-0 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 03.08.2007 (JavaScript erforderlich)
Literatur
- Gerhart Jander, Ewald Blasius et al.: Einführung in das anorganisch-chemische Praktikum. 14. neu bearb. Aufl.. Hirzel, Stuttgart, 1995. ISBN 3777606723
- Michael Binnewies, Manfred Jäckel et al.: Allgemeine und Anorganische Chemie. Spektrum Akademischer Verlag, 2003. ISBN 3827402085
Wikimedia Foundation.

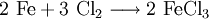
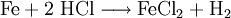
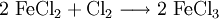
-chlorid.JPG)