- Erythrose
-
Strukturformel 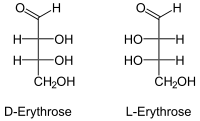
Fischer-Projektion, offenkettige Darstellung Allgemeines Name Erythrose Andere Namen - (2R,3R)-2,3,4-trihydroxybutanal (D-Erythrose)
- (2S,3S)-2,3,4-trihydroxybutanal (L-Erythrose)
Summenformel C4H8O4 CAS-Nummer 583-50-6 (D-Erythrose) PubChem 94176 Kurzbeschreibung farblose, sirupöse Flüssigkeit[1]
Eigenschaften Molare Masse 120,10 g·mol-1 Aggregatzustand flüssig
Löslichkeit gut in Wasser[1]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [2] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Erythrose ist ein Monosaccharid aus der Gruppe der Tetrosen. Wegen der endständigen Aldehyd-Gruppe gehört die Erythrose zu den Aldosen. Es gibt zwei Stereoisomere, die D-Erythrose und die L-Erythrose. Der IUPAC-Name der D-Form ist (2R,3R)-2,3,4-trihydroxybutanal. L-Erythrose [Synonym: (2S,3S)-2,3,4-trihydroxybutanal] besitzt nur geringe Bedeutung. Die Threose ist ein Diastereomer zur Erythrose.
Reaktionen
Mit Salzsäure reagiert Erythrose langsam zur Milchsäure. Im Kohlenhydratstoffwechsel ist Erythrose-4-phosphat ein wichtiges Zwischenprodukt.[3] Es entsteht im Verlauf des Pentosephosphatwegs unter der Einwirkung des Enzyms Transaldolase aus Sedoheptulose-7-phosphat und Glycerinaldehyd-3-phosphat, zusammen mit Fructose-6-phosphat. Pflanzen und vielen Mikroorganismen dient Erythrose-4-phosphat zusammen mit Phosphoenolpyruvat (PEP) im Shikimisäureweg zur Synthese der aromatischen Aminosäuren Tryptophan, Tyrosin und Phenylalanin.[4] Außerdem kann Erythrose-4-phosphat in Pflanzen, Bakterien und Pilzen zur Synthese von Pyridoxin, dem Vitamin B6 verwendet werden.
Einzelnachweise
- ↑ a b Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ Datenblatt Erythrose bei Sigma-Aldrich, abgerufen am 12. Juni 2011.
- ↑ H. P. T. Ammon: Hunnius pharmazeutisches Worterbuch, Walter de Gruyter, 2004, ISBN 3-11-017475-8.
- ↑ J. M. Berg, J. L. Tymoczko, L. Stryer: Biochemie. 6. Auflage. Spektrum Akademischer Verlag, Elsevier GmbH, München 2007; S. 644–645, 773–775; ISBN 978-3-8274-1800-5.
Weblinks
Wikimedia Foundation.
