- Pentosephosphatweg
-
Übergeordnet Glucoseabbau
NADPH-RegenerationUntergeordnet Oxidativer Weg
Reduktiver WegGene Ontology AmiGO QuickGO Der Pentosephosphatweg (auch Hexosemonophosphat-Zyklus, Hexosemonophosphat-Shunt[1] oder 6-Phosphogluconatweg) ist ein Stoffwechselweg, der in den meisten Lebewesen vorkommt. Er stellt eine Möglichkeit der Verwertung von Kohlenhydraten dar, beispielsweise von Glucose, bei der Reduktionsäquivalente in Form von NADPH generiert werden. Darüber hinaus dient er der Interkonversion von verschiedenen Kohlenhydraten. Diese Prozesse finden im Zytosol der Zelle, bei Pflanzen auch in den Chloroplasten statt.
Inhaltsverzeichnis
Allgemeiner Ablauf und Produkte
Der Pentosephosphatweg lässt sich in einen oxidativen, irreversiblen und einen nicht-oxidativen (reduktiven), reversiblen Abschnitt aufteilen. Beide Wege müssen aber nicht unmittelbar nacheinander ablaufen. Beispielsweise wird im Zuge der CO2-Assimilation in Pflanzen (Calvin-Zyklus) nur der reduktive Weg eingeschlagen.
Beim Pentosephosphatweg wird im oxidativen Weg aus D-Glucose unter Gewinn von NADPH/H+ Ribulose-5-phosphat gebildet. Die Pentose kann in Metaboliten der Glycolyse umgewandelt werden oder als Grundbaustein für die Biosynthese von Nukleotiden (DNA, RNA) und Coenzymen (ATP, Coenzym A, NAD+, FAD) dienen. NADPH wird als Reduktionsmittel für den Anabolismus verwendet und dient der Aufrechterhaltung eines reduzierenden Milieus im Zytoplasma. NADPH dient im Gegensatz zu NADH nicht der Energiegewinnung in der Atmungskette. Neben dem Citrat-Shuttle ist der Pentosephosphatweg die einzige Möglichkeit, NADPH zu gewinnen.[2]
Im nicht-oxidativen, reversibel ablaufenden Teil können verschiedene Kohlenhydrate ineinander umgewandelt werden. Beispielsweise kann die aus dem oxidativen Zweig entstandene Pentose (C5-Zucker) in Metabolite der Glycolyse transformiert werden. Als Zwischenprodukte treten C3-Zucker (Triosen), C4-Zucker (Tetrosen), C5-Zucker (Pentosen), C6-Zucker (Hexosen) und ein C7-Zucker (Heptose) auf.
Oxidativer Teil
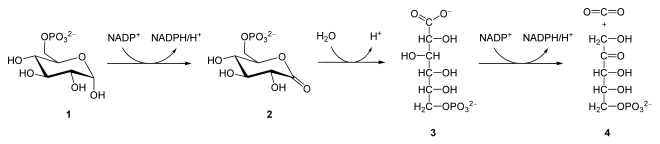
Wie in der Glycolyse findet als erster Schritt die Glucokinase-Reaktion statt, bei der α-D-Glucose zu α-D-Glucose-6-phosphat (1) unter ATP-Verbrauch phosphoryliert wird.
Die Glucose-6-phosphat-Dehydrogenase (G6PDH) bildet unter Erzeugung von NADPH/H+ 6-Phosphoglucono-δ-Lacton (2), einen intramolekularen Ester. Sie ist hochspezifisch gegenüber Glucose-6-phosphat und NADP+, jedoch nicht für NAD+. Es handelt sich hierbei um eine Oxidation an C1-Atom der Glucose. Das Gleichgewicht dieser Reaktion liegt weit auf der Seite der Produkte. Auch die Hexose-6-phosphat-Dehydrogenase (X6PDH) kann diese Reaktion katalysieren. Sie zeigt aber eine geringere Spezifität gegenüber Glucose und kann auch andere Hexosen oxidieren. In vielen Zellen katalysiert diese allerdings den ersten Schritt des Pentosephosphatweges.[3]
Als nächstes setzt die 6-Phosphogluconolactonase 6-Phosphoglucono-δ-Lacton zu 6-Phosphogluconat (3) um. Dieses wird anschließend über die 6-Phosphogluconat-Dehydrogenase zu Ribulose-5-phosphat (4) oxidiert und decarboxyliert, wobei NADPH/H+ und CO2 entstehen. Hierbei findet also eine Oxidation an C3-Atom statt.
Die Gesamtbilanz für den oxidativen Teil des Pentosephosphatweges, ausgehend von Glucose-6-phosphat, lautet somit:
Nicht-Oxidativer Teil
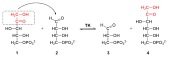 Katalysierte Übertragung einer Glycolaldehydgruppe von Xylulose-5-phosphat (1) auf Erythrose-4-phosphat (2). Daher wird die Transketolase auch als Glycoaldehyd-Transferase bezeichnet.[3] Es entstehen Glycerinaldehyd-3-phosphat (3) und Fructose-6-phosphat (4).
Katalysierte Übertragung einer Glycolaldehydgruppe von Xylulose-5-phosphat (1) auf Erythrose-4-phosphat (2). Daher wird die Transketolase auch als Glycoaldehyd-Transferase bezeichnet.[3] Es entstehen Glycerinaldehyd-3-phosphat (3) und Fructose-6-phosphat (4).
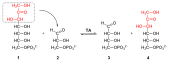 Katalysierte Übertragung einer Dihydroxyacetongruppe von Sedoheptulose-7-phosphat (1) nach Glycerinaldehyd-3-phosphat (2). Daher wird die Transaldolase auch als Dihydroxyaceton-Transferase bezeichnet.[3] Es entstehen Erythrose-4-phosphat (3) und Fructose-6-phosphat (4).
Katalysierte Übertragung einer Dihydroxyacetongruppe von Sedoheptulose-7-phosphat (1) nach Glycerinaldehyd-3-phosphat (2). Daher wird die Transaldolase auch als Dihydroxyaceton-Transferase bezeichnet.[3] Es entstehen Erythrose-4-phosphat (3) und Fructose-6-phosphat (4).
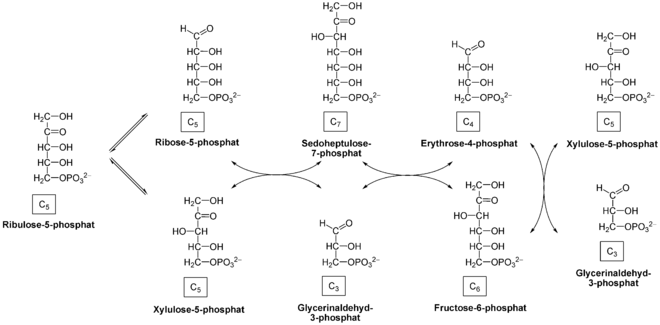
Im reversiblen Teil des Pentosephosphatweges werden die C4-, C5-, C6- und ein C7-Zucker ineinander transformiert, er dient nicht der Erzeugung weiterer Reduktionsäquivalente. Diese Reaktionen werden durch zwei Enzyme katalysiert. Eine Transketolase überträgt zwei, die Transaldolase drei Kohlenstoffeinheiten. Die Übertragung von Kohlenstoffatomen durch Transaldolase und Transketolase verbraucht kein ATP und ist im Fall der Transketolase lediglich vom Cofaktor Thiaminpyrophosphat (TPP, aus Vitamin B1) abhängig.
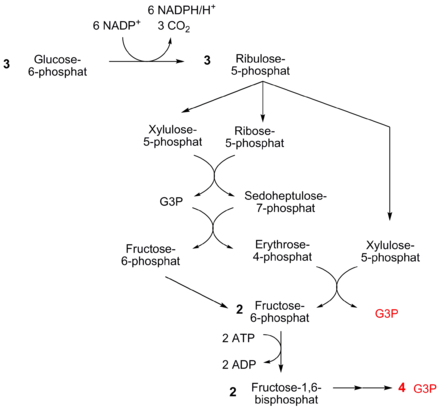
Exemplarisch ist in der Abbildung ein mögliches Schicksal von Ribulose-5-phosphat abgebildet, welches beim oxidativen Weg des Pentosephosphatweges entstanden ist.
Ribulose-5-phosphat wird dabei über die Ribose-5-phosphat-Isomerase zu Ribose-5-phosphat isomerisiert, kann aber auch mithilfe der Ribulosephosphat-3-Epimerase zu Xylulose-5-phosphat (X5P) umgelagert werden. Beide Produkte nehmen an den folgenden Reaktionen teil. Eine Transketolase überträgt dann eine C2-Einheit aus Xylulose-5-phosphat auf Ribose-5-phosphat, so dass aus ersterem Glycerinaldehyd-3-phosphat (GAP), aus letzterem Sedoheptulose-7-phosphat (S7P) entstehen. Wenn bei S7P eine C3-Einheit auf GAP übertragen wird, entstehen Erythrose-4-phosphat (E4P) und Fructose-6-phosphat. Diese Reaktion katalysiert eine Transaldolase. Schließlich transferiert eine Ketolase zwei Kohlenstoffeineinheiten aus einem weiteren Molekül X5P auf E4P, so dass schließlich ein weiteres Molekül Fructose-6-phosphat und GAP entstehen.
Bilanz
Bei drei Molekülen Ribulose-5-phosphat ergibt sich im reduktiven Weg des Pentosephosphatweges folgende Bilanz:
Wenn der oxidative Weg mit berücksichtigt wird, entstehen somit aus drei Molekülen Glucose-6-phosphat:
Reduktiver Pentosephosphatweg
Im Zuge des Calvin-Zyklus entsteht Glycerinaldehyd-3-phosphat. Hierbei werden fünf Moleküle unter Einbeziehung der Enzyme aus der Gluconeogenese (Triosephosphatisomerase, Aldolase, Fructose-1,6-bisphosphatase) und durch Transketolasen und -aldolasen zu drei Molekülen Ribulose-5-phosphat umgebaut. In obiger Abbildung entspricht dies dem Weg von rechts nach links.
In der Literatur wird diese Regenerierung auch als reduktiver Pentosephosphatweg bezeichnet.[4]
Variationen
Durch den Pentosephosphatweg werden Reduktionsäquivalente in Form von NADPH erzeugt, während in der Glykolyse NADH gebildet wird. Werden beispielsweise verstärkt NADPH und Pentosen gebraucht, fließt Glucose in diesen Stoffwechselweg ein. Das ist vor allem in Geweben der Fall, in denen Fettsäure- oder Steroid-Synthese stattfindet. Zur Erzeugung von NADH und ATP können die Intermediate des Pentosephosphatweges aber wieder zurück in die Glykolyse fließen. Der Pentosephosphatweg kann somit als eine molekulare Drehscheibe aufgefasst werden, bei der unterschiedliche Bedürfnisse der Zelle an NADPH, Ribosen, ATP, NADH und Pyruvat adressiert werden. Er verknüpft damit den anabolen und katabolen Glucosestoffwechsel. Im Folgenden werden verschiedene Fälle diskutiert:
Viel NADPH soll generiert werden
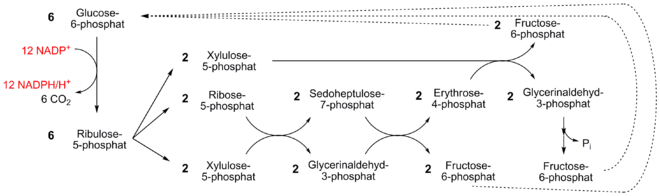
Für den Fall, dass möglichst viele Moleküle NADPH gebraucht werden, kann folgende Variante des Pentosephosphatweges eingeschlagen werden (vgl. Abbildung):
Zunächst werden sechs Moleküle Glucose-6-phoshat über den oxidativen Teil des PP-Weges zu sechs Molekülen Ribulose-5-phosphat abgebaut. Dabei entstehen 12 Moleküle NADPH. Ribulose-5-phosphat kann dann – wie abgebildet – über mehrere Interkonversionen im reduktiven Teil des Weges zu fünf Molekülen Fructose-6-phosphat transformiert werden. Dies geschieht unter Einbeziehung der Enzyme der Gluconeogenese. Da diese im Gleichgewicht mit Glucose-6-phosphat stehen, fließen diese in den Zyklus wieder ein. Die Bilanz lautet infolgedessen:
In der Gesamtbilanz wird demnach ein Molekül Glucose-6-phosphat totaloxidiert zu sechs Molekülen CO2, hierbei entstehen 12 Moleküle NADPH:
Jedoch tritt diese Variante des Pentosephosphatweges, bei dem ausschließlich NADPH erzeugt wird, in Säugetierzellen in eher geringen Maßen auf.[5] In der Literatur wird diese vollständige Oxidation der Glucose auch als „oxidativer Pentosephosphatweg“ bzw. nach seinen Entdeckern als „Warburg-Dickens-Horecker-Abbauweg“ bezeichnet.[6]
Ribose-5-phosphat wird benötigt
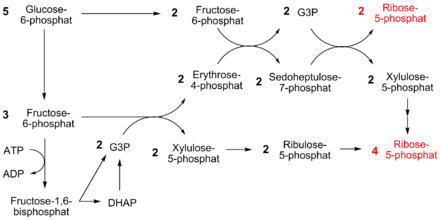
Zellen im Knochenmark, der Haut, Darmschleimhaut und auch Tumorzellen teilen sich schnell und benötigen infolgedessen viel DNA und RNA.[4] Der Aufbau von DNA und RNA erfordert viele Ribosen. Bei einer Alternative des PP-Weges kann die Generierung von Ribose-5-phosphat akzentuiert werden (vgl. Abbildung).
Im obigen Beispiel werden aus fünf Molekülen Glucose-6-phosphat sechs Moleküle Ribose-5-phosphat erzeugt. Hierbei wird der oxidative Teil des PP-Weges umgangen, es finden nur Umwandlungen durch Ketolasen und Aldolasen statt. Jedoch wird bei diesem Vorgang auch ein Molekül ATP verbraucht.
Bilanz:
NADH, NADPH und ATP werden gebraucht
Für den Fall, dass die Zelle neben NADPH auch Energie aus dem Abbau von Glucose erzeugen möchte, kann eine Kombination des PP-Weges und der Glykolyse eingeschlagen werden (vgl. Abbildung).
Im oxidativen Teil des PP-Weges werden drei Moleküle Glucose-6-phosphat zu drei Molekülen Ribulose-5-phosphat oxidativ abgebaut, dabei entstehen sechs Moleküle NADPH. Ribulose-5-phosphat wird dann über verschiedene Reaktionen des weiteren Weges in fünf Moleküle GAP umgewandelt. Hierbei werden zwar zwei Moleküle ATP verbraucht, jedoch wird GAP in der weiteren Folge der Glykolyse zu Pyruvat verstoffwechselt. Dabei entstehen pro Molekül Pyruvat zwei Moleküle ATP und ein Molekül NADH.
In der Gesamtbilanz ergibt sich:
Regulation
Die Substratverfügbarkeit im nicht-oxidativen Teil des Pentosephosphatweges wird über Fließgleichgewichte und Stoffwechselbedürfnisse der Zelle gesteuert (vgl. Abschnitt Variationen). Beim oxidativen Teil des Weges stellt die G6PDH als Schlüsselenzym die Hauptregulationsstelle dar. Die kompetitive Hemmung des Enzyms erfolgt hierbei im Zuge einer Endprodukthemmung: NADPH und Zwischenprodukte der Fettsäuresynthese (Acyl-CoA) inhibieren die Glucose-6-phosphat-Dehydrogenase.[7] Dagegen ist NADP+ ein allosterischer Aktivator der Dehydrogenase.[5]
Vorkommen
Die Enzyme des Pentosephosphatweges sind im Zytoplasma von fast allen Zellen vorhanden. Da NADPH für die Synthese von Fettsäuren und Steroiden benötigt wird, findet der PP-Weg insbesondere in Leberzellen (Fettsäure- und Cholesterinsynthese) und im Fettgewebe (Fettsäureesynthese) statt. Auch andere Gewebe, in denen Fettsäuren und Steroide synthetisiert werden, benötigen NADPH und damit den Pentosephosphatweg. Dies sind beispielsweise die milchproduziernde weibliche Brust (Glandula mammaria), der Hoden, der Eierstock und die Nebennierenrinde (Steroidsynthese).[8][9]
In Muskelzellen jedoch fehlen größtenteils die Enzyme für diesen Stoffwechselweg. Das liegt daran, dass dort Glucose-6-phosphat in der Glykolyse und Citratzyklus zur Energiegewinnung metabolisiert wird.
Abhängigkeit der Erythrozyten vom Pentosephosphatweg
- → Hauptartikel Glucose-6-Phosphat-Dehydrogenase-Mangel
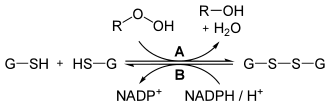 Reduktion von Peroxiden (R–O–OH) durch Gluthation (G–SH) und der Glutathionperoxidase (A). Für die Regeneration wird NADPH + H+ benötigt.[5]
Reduktion von Peroxiden (R–O–OH) durch Gluthation (G–SH) und der Glutathionperoxidase (A). Für die Regeneration wird NADPH + H+ benötigt.[5]
Erythrozyten stellen eine Besonderheit dar, da sie völlig auf den Pentosephosphatweg angewiesen sind. Für sie ist es der einzige Weg, durch den Reduktionsäquivalente in Form von NADPH erzeugt werden können.
In Geweben besteht die Gefahr vor oxidativen Schäden durch reaktive Sauerstoffspezies (ROS). Erythrozyten sind durch den Transport von Sauerstoff hierbei besonders gefährdet. ROS, zum Beispiel Wasserstoffperoxid (H2O2), schädigen Proteine, DNA und Zellwandlipide.[4] Entweder wird H2O2 durch eine Katalase zu Wasser und Sauerstoff gespalten, oder oxidative Schäden werden dadurch minimiert, dass Glutathion ROS unschädlich macht. Eine Glutathionperoxidase kann Peroxide reduzieren (vgl. Abbildung), indem zwei Moleküle Glutathion oxidiert werden. NADPH dient als schützendes Reduktionsmittel, da es Glutathion regeneriert. Dies wird durch eine Glutathionreduktase katalysiert.
Bei Menschen mit einem Defekt in der Glucose-6-phosphatdehydrogenase (G6PDH), sind die Erythrozyten erhöhtem oxidativen Stress ausgesetzt, da sie im Gegensatz zu anderen Geweben keine Hexulose-6-phosphat-Dehydrogenase exprimieren , sodass sich ein Defekt drastisch auf den Pentosephosphatweg auswirkt. Es wird zu wenig NADPH generiert, sodass mehr oxidative Schäden, beispielsweise in der Membran, entstehen. G6PDH-Mangel führt daher zu einer hämolytischen Anämie.[3]
Andererseits haben Menschen mit einem G6PDH-Defekt einen erhöhten Schutz gegen Malaria. Der Erreger Plasmodium falciparum vermehrt sich in den Erythrozyten, ist aber sehr empfindlich gegenüber oxidativem Stress. Dies führt zu einem Selektionsvorteil: Ein G6PDH-Mangel ist in den Gegenden verbreitet, bei denen Malaria häufig auftritt.[4]
Erythrozyten haben keinen Zellkern und keine Mitochondrien. Das bedeutet, dass sie weder einen Citratzyklus betreiben können, noch, dass sie Bedarf an Ribose-5-phosphat haben, um DNA und RNA zu erzeugen. Sie könnten also alleine mit dem oxidativen Zweig genügend Antioxidantien erzeugen. Dies entzieht jedoch einerseits der energieliefernden Glycolyse die Glucose, andererseits würde bald ein osmotisches Problem durch die Pentose entstehen. Durch den nicht-oxidativen Zweig werden aber zwei Moleküle Xylulose-5-phosphat und ein Molekül Ribose-5-phosphat zu Glycerinaldehyd-3-phosphat und zwei Molekülen Fructose-6-phosphat umgesetzt. Diese Produkte können die Erythrozyten in der Glycolyse zur Energiegewinnung verwenden (vgl. Abschnitt oben).
Literatur
- Reginald Garrett und Charles M. Grisham: Biochemistry. (International Student Edition). Thomsom Learning Inc.; 3. Auflage 2005; ISBN 0-534-41020-0; S. 725–735
- Thomas M. Devlin (Hrsg.): Textbook of Biochemistry with Clinical Correlations. Wiley & Sons; 6. Auflage 2005; ISBN 978-0-471-67808-3; S. 638–643
- H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn und Carsten Biele (Übersetzer): Biochemie. Pearson Studium; 4. aktualisierte Auflage 2008; ISBN 978-3-8273-7312-0; S. 490–496
- Werner Müller-Esterl: Biochemie, eine Einführung für Mediziner und Naturwissenschaftler. Spektrum Akademischer Verlag, 2004, ISBN 3-8274-0534-3, S.522–527
- Albert Lehninger, Michael Cox und David L. Nelson: Lehninger Principles of Biochemistry. W H Freeman & Co; 5. Auflage 2008; ISBN 978-0-7167-7108-1; S. 558–563
Einzelnachweise
- ↑ Hier im Sinne von „Quereinstieg“ von Produkten in die Glykolyse
- ↑ David Nelson, Michael Cox: Lehninger Biochemie. Springer, Berlin; 4., vollst. überarb. u. erw. Auflage 2009; ISBN 978-3-540-68637-8; S. 1076
- ↑ a b c d H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn und Carsten Biele (Übersetzer): Biochemie. Pearson Studium; 4. aktualisierte Auflage 2008; ISBN 978-3-8273-7312-0; S. 490–496
- ↑ a b c d Albert Lehninger, Michael Cox und David L. Nelson: Lehninger Principles of Biochemistry. W H Freeman & Co; 5. Auflage 2008; ISBN 978-0-7167-7108-1; S. 558–563
- ↑ a b c Werner Müller-Esterl: Biochemie, eine Einführung für Mediziner und Naturwissenschaftler. Spektrum Akademischer Verlag, 2004, ISBN 3-8274-0534-3, S.522–527
- ↑ Karlsons Biochemie und Pathobiochemie. ISBN 978-3133578158, S. 258
- ↑ Reginald Garrett und Charles M. Grisham: Biochemistry. (International Student Edition). Thomsom Learning Inc.; 3. Auflage 2005; ISBN 0-534-41020-0; S. 725–735
- ↑ Thomas M. Devlin (Hrsg.): Textbook of Biochemistry with Clinical Correlations. Wiley & Sons; 6. Auflage 2005; ISBN 978-0-471-67808-3; S. 638–643
- ↑ Jeremy M. Berg, Lubert Stryer und John L. Tymoczko: Biochemie. Spektrum Akademischer Verlag; 6. Auflage 2007; ISBN 978-3-8274-1800-5; S. 650
Weblinks
Wikimedia Foundation.