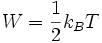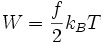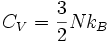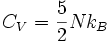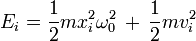- Gleichverteilungssatz
-
Das Äquipartitionstheorem (auch Gleichverteilungssatz genannt) besagt, dass im thermischen Gleichgewicht bei der Temperatur T im Mittel jeder Freiheitsgrad die gleiche Energie W besitzt:
Dabei ist kB die Boltzmann-Konstante. Also gilt für Teilchen mit f Freiheitsgraden:
Der Gleichverteilungssatz gilt nur für Freiheitsgrade, deren Variable im Ausdruck für die Energie (d.h. in der Hamilton-Funktion) als Quadrat vorkommen. Des Weiteren dürfen diese Freiheitsgrade nicht "eingefroren" sein, das heißt, dieser Freiheitsgrad muss tatsächlich angeregt werden. Beispielsweise werden Molekülschwingungen "kleiner" Moleküle wie H2 oder O2 bei Raumtemperatur nicht angeregt, weil die für den Übergang auf den niedrigsten angeregten Zustand nötige Energie nicht erreicht wird.
Freiheitsgrade, deren Variable nicht in der Hamilton-Funktion vorkommen, führen natürlich zu keinem Beitrag zur Energie; für Freiheitsgrade, die anders als in rein quadratischer Form vorkommen, lässt sich die mittlere Energie nicht so einfach berechnen.
Beispiele
Spezifische Wärme von Gasen
Aus dem Äquipartitionstheorem lässt sich beispielsweise die Wärmekapazität (spezifische Wärme) CV eines idealen Gases bei konstantem Volumen berechnen. Wir betrachten zuerst ein einatomiges Gas (Edelgas):
Die Energie des Gases ist durch seine kinetische Energie der Atome gegeben; für jedes Atom gilt
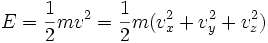 ,
,
wobei m die Masse des Atoms ist, und vi die Komponenten des Geschwindigkeits-Vektors. Es kommen also drei Freiheitsgrade je Atom als Quadrat vor, daher ist die mittlere Energie je Atom W = (3 / 2)kBT. Daraus ergibt sich unmittelbar die Wärmekapazität von (3 / 2)kB je Atom, also
für ein einatomiges Gas mit N Atomen.
Bei zweiatomigen Gasmolekülen, wie sie beispielsweise Wasserstoff, Sauerstoff und Stickstoff bilden, sind zusätzlich zwei Rotationsfreiheitsgrade zu berücksichtigen (die Rotation um die Molekülachse, also um die dritte Raumrichtung, ist nicht relevant, und die Molekülschwingungen sind "eingefroren"). Daraus ergeben sich 5 Freiheitsgrade je Molekül, und somit
für ein Gas mit N Molekülen.
Wärmekapazität von Festkörpern
Bei Festkörpern kann die Schwingung der Atome um ihre Ruheposition durch das Potential eines harmonischen Oszillators angenähert werden. Je Raumrichtung i ist die dazugehörige Energie durch
gegeben, wobei ω0 die Kreisfrequenz des Oszillator ist, und xi die Auslenkung des Atoms aus seiner Ruhelage in Richtung i bedeutet. Der erste Summand ist die potentielle Energie, der zweite die kinetische Energie.
Es sind daher zwei Freiheitsgrade je Atom und Raumrichtung zu betrachten, in drei Dimensionen also sechs Freiheitsgrade je Atom, und bei N Atomen erhält man f = 6N. Dieses Ergebnis bleibt gleich, wenn man (vom Abstand linear abhängige) Kräfte zwischen den Atomen berücksichtigt.
Daraus ergibt sich unmittelbar die Wärmekapazität von
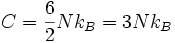 .
.
Diese Gleichung ist als Dulong-Petit-Gesetz bekannt. Auch hier gilt, dass die Freiheitsgrade nicht „eingefroren“ sein dürfen (die Temperatur muss deutlich über der Debye-Temperatur liegen); ansonsten kann die Wärmekapazität nur mit dem Debye-Modell berechnet werden.
Wikimedia Foundation.