- Alkanone
-
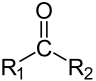
Dieser Artikel wurde aufgrund von Mängeln auf der Qualitätssicherungsseite der Redaktion Chemie eingetragen. Dies geschieht, um die Qualität der Artikel aus dem Themengebiet Chemie auf ein akzeptables Niveau zu bringen. Dabei können Artikel gelöscht werden, die nicht signifikant verbessert werden können. Hilf mit, die Mängel dieses Artikels zu beseitigen, und beteilige dich an der Diskussion. Ketone sind chemische Verbindungen, die als funktionelle Gruppe eine nicht endständige Carbonylgruppe (>C=O) (auch Ketogruppe genannt) enthalten. Im Gegensatz zu den Aldehyden ist hier der Carbonylkohlenstoff in beide Bindungsrichtungen mit Kohlenstoffatomen verbunden. Ketone kann man als Oxidationsprodukte sekundärer Alkohole auffassen. Die von den Alkanen ableitbaren Ketone nennt man auch Alkanone. Das einfachstes Keton ist Aceton. Ein einfaches aromatisches Keton ist Benzophenon (Diphenylketon). Ein gemischtes Keton ist Acetophenon (Methylphenylketon).
Inhaltsverzeichnis
Nomenklatur
Nach der IUPAC-Nomenklatur erhalten Ketone das Suffix „-on“. Dementsprechend heißt das vom Propan abgeleitete Keton Propanon (CH3-CO-CH3, Trivialname Aceton). Bei Ketonen mit mehr als 3 C-Atomen wird die Stelle der C=O Doppelbindung entweder vor der -on-Endung, oder vor dem Namen angegeben. Beispielsweise heißt: CH3-CH2-CH2-CO-CH3 Pentan-2-on.
Eigenschaften
Niedermolekulare Ketone sind farblose, leichtbewegliche Flüssigkeiten und aufgrund der Polarisierung des C-Atoms der Carbonylgruppe in Wasser löslich. Niedermolekulare Ketone zeichnen sich durch einen meist angenehmen, fruchtigen Geruch aus. Höhermolekulare Ketone sind feste Stoffe.
Ketone besitzen auf Grund des +I-Effekts der Alkylsubstituenten am Carbonyl-Kohlenstoffatom eine niedrigere Reaktionsfreudigkeit als Aldehyde und neigen nicht zu einer Polymerisation. Im Unterschied zu den Aldehyden erfolgt mit Ketonen keine Reaktion bei der Fehlingscher Probe, da die Ketogruppe unter Erhalt des Kohlenstoffgerüsts nicht weiter oxidiert werden kann.
Herstellung
- Ketone lassen sich durch Oxidation von sekundären Alkoholen herstellen.
- Eine weitere Herstellungsmethode ist die Ozonolyse von Alkenen.
- Die wichtigste Herstellungsmethode für aromatische Ketone ist die Friedel-Crafts-Acylierung.
- Nach der Ketonsynthese von Gilman & Van Ess erhält man aus einer Carbonsäure (R1+1) und einer Lithium-Alkyl-Verbindung (R2) durch Hydrolyse das analoge Keton
- Eine weitere Herstellungsmethode ist die Umsetzung von Weinreb-Amiden mit Alkyl-Lithium-Verbindungen und anschließender wässrig-saurer Aufarbeitung.
- Eine mittlerweile historische Synthese stellt die sogenannte Kalksalzdestillation dar, bei der Calciumsalze von Carbonsäuren trocken erhitzt und das gasförmig freiwerdende Keton rekondensiert wird (beispielsweise zur Darstellung von Aceton aus Calciumacetat).
Reaktionen
Ketone gehen ähnlich wie Aldehyde Additions- und Kondensationsreaktionen ein.
Ketone stehen mit ihrer tautomeren Form, den Enolen im Gleichgewicht (Keto-Enol-Tautomerie):
H H | | R - C - C = O <-- R - C = C - O | | -> | | H R H R
Zum Schutz gegen unerwünschte Reaktionen werden Ketone mit Diolen zu Vollacetalen (siehe Schutzgruppe) umgesetzt:
R-C=O R-C-R | + HO-R'-OH --> / \ + Wasser R O O \ / R'
Wichtige Vertreter der Ketone
Spektroskopie von Ketonen
In IR-Spektren von Ketonen und Aldehyden findet man die charakteristische Bande der C=O-Valenzschwingung im Bereich von 1690–1750 cm−1.
Siehe auch
Weblinks
Wikimedia Foundation.