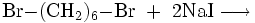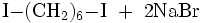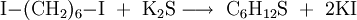- Hexamethyleniodid
-
Strukturformel 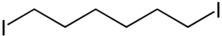
Allgemeines Name 1,6-Diiodhexan Andere Namen - Hexamethyleniodid
- 1,6-Dijodhexan
- Hexamethylenjodid
Summenformel C6H12I2 CAS-Nummer 629-09-4 Kurzbeschreibung hellgelbe Flüssigkeit[1] Eigenschaften Molare Masse 337,97 g/mol Aggregatzustand flüssig
Dichte 2,05 g/cm3[1]
Schmelzpunkt Siedepunkt 141–142 °C (13 hPa)
Löslichkeit unlöslich in Wasser[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [2] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26-37 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 1,6-Diiodhexan ist eine chemische Verbindung. Ihre Struktur leitet sich vom Grundgerüst des Hexans ab und besitzt an beiden Kettenenden jeweils einen Iodsubstituenten.
Inhaltsverzeichnis
Darstellung
Die Verbindung kann aus der Reaktion zwischen 1,6-Hexandiol, rotem Phosphor und elementarem Iod gewonnen werden.[3] Eine weitere Möglichkeit besteht in der Finkelstein-Reaktion von 1,6-Dibromhexan mit Natriumiodid.[4]
Eigenschaften
1,6-Diiodhexan ist eine gelbliche Flüssigkeit, die bei 9–10 °C erstarrt und bei einem Druck von 13 hPa bei 141–142 °C siedet. Der Brechungsindex beträgt bei einer Temperatur von 20 °C und einer Wellenlänge von 589 nm 1,5852.[5] Der Flammpunkt liegt bei 113 °C.[5]
Verwendung
Die Iodsubstituenten an den Enden der Alkylkette sind hervorragende Abgangsgruppen, weshalb 1,6-Diiodhexan durch Umsetzung mit Nukleophilen zur Synthese von 1,6-Hexanderivaten eingesetzt werden kann. So kann 1,6-Diiodhexan ebenso wie 1,6-Dibromhexan[6] zur Synthese von Thiepan genutzt werden. Hierzu wird es mit Kaliumsulfid umgesetzt.[7]
Quellen
- ↑ a b c d Sicherheitsdatenblatt Acros
- ↑ Sicherheitsdatenblatt Alfa-Aesar
- ↑ A. Müller, E. Rölz: Über die Einwirkung von 1.6-Dijod-n-hexan auf Amine, in: Chemische Berichte 1928, 61, 570–574.
- ↑ F. Asinger, B. Scheuffler: Über den Einfluß von Natriumsalzen von Hexadecandicarbonsäuren auf die oberflächenaktiven und waschtechnischen Eigenschaften von Natriumsalzen von Hexadecanmonocarbonsäuren, J. Prakt. Chem. 1960, 10, 265–289
- ↑ a b Sicherheitsdatenblatt Sigma-Aldrich
- ↑ A. Singh, A. Mehrotra, S. L. Regen: High Yield Medium Ring Synthesis of Thiacycloalkanes, in: Synth. Commun. 1981, 11, 409–412.
- ↑ J. v. Braun: Über cyclische Sulfide, in: Chem. Ber. 1910, 43, 3220–3226.
Wikimedia Foundation.