- Hundsche Regel
-
Die nach Friedrich Hund benannten Hundschen Regeln machen eine Aussage darüber, in welcher Drehimpulskonfiguration die Elektronen in den Orbitalen eines Atoms im Grundzustand vorliegen. Diese Regeln gelten dabei im Rahmen der LS-Kopplung, die insbesondere für leichte Elemente erfüllt ist. Aber auch für schwerere Atome können die Regeln gute Ergebnisse erzielen.
Inhaltsverzeichnis
Hintergrund
Will man den Aufbau der Elektronenhülle eines Atoms mit Z Elektronen theoretisch bestimmen, so muss im Prinzip die Schrödingergleichung für dieses Problem gelöst werden. Dies ist analytisch jedoch nur möglich, wenn man die elektrostatische Wechselwirkung der Elektronen untereinander vernachlässigt (siehe Drei-Körper-Problem). Stattdessen verwendet man näherungsweise ein abgeschirmtes Coulomb-Potential für die Wechselwirkung zwischen Elektronen und Kern, um der abgeschwächten Anziehung von äußeren Elektronen gerecht zu werden.
Eine derartige Rechnung beschreibt die Höhe der Energieniveaus hinreichend gut, liefert jedoch nur eine Abhängigkeit von der Hauptquantenzahl n und der Nebenquantenzahl l (mit l < n). Jede solche Unterschale kann mit (2l + 1) Elektronen gefüllt werden, welche sich nach dem Pauli-Prinzip in der magnetischen Quantenzahl ml oder der Spinquantenzahl ms unterscheiden müssen. Um den Grundzustand des Atoms zu ermitteln, werden nur die Energieniveaus vom kleinsten angefangen mit Elektronen gefüllt. Hat man nicht ausreichend Elektronen übrig, um das höchste Energieniveau komplett zu füllen, so kommt man zu einem Zuordnungsproblem. Da es energetisch egal ist, welche magnetische oder Spinquantenzahl die Elektronen auf einer Unterschale annehmen, könnten theoretisch beliebige (erlaubte) Werte vergeben werden. Man nennt einen solchen Grundzustand entartet.
In der Praxis stellt man z. B. durch Messen der magnetischen Suszeptibilität fest, dass die Zuordnung nicht egal ist. Die Entartung des Grundzustand ist also ein Artefakt aus der oben erwähnten Vernachlässigung der Elektron-Elektron Wechselwirkung. Um nun eine theoretische Vorhersage über die Elektronenverteilung auf magnetische und Spinquantenzahl treffen zu können, zeigt es sich, dass ein Satz aus simplen Regeln, den Hundschen Regeln, genügt.
Russell-Saunders-Kopplung (LS-Kopplung)
- Hauptartikel: LS-Kopplung
Die magnetischen Momente von Bahndrehimpuls und Spin der Elektronen eines Atoms wechselwirken nicht separat, sondern durch Addition zu einem Gesamtdrehimpuls als Ganzes mit einem externen Magnetfeld. Wenn dabei die Coulomb-Wechselwirkung der Elektronen untereinander groß gegenüber ihrer eigenen Spin-Bahn-Wechselwirkung ist, kann man den Gesamtdrehimpuls im Rahmen der so genannten LS-Kopplung bestimmen. Hierbei gelten folgende Regeln:
- Die Bahndrehimpulse
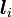 der Elektronen addieren sich zu dem Gesamtbahndrehimpuls
der Elektronen addieren sich zu dem Gesamtbahndrehimpuls 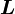 ,
,
-
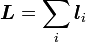 ,
,
- mit
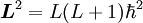 .
.
- Die Spins
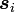 der Elektronen addieren sich zu dem Gesamtspin
der Elektronen addieren sich zu dem Gesamtspin 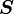 ,
,
-
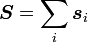 ,
,
- mit
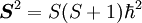 .
.
- Gesamtbahndrehimpuls und -spin addieren sich zu dem Gesamtdrehimpuls
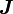 ,
,
-
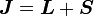 ,
,
- mit
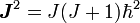 und
und 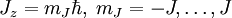
Statt der bisherigen, für jedes Elektron separaten Beschreibung seines Zustandes durch die Quantenzahlen l,ml,ms, genügen nun neue Quantenzahlen für das elektronische Gesamtsystem. Diese lauten L,S,J,mJ und gehören zu
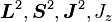 wie oben beschrieben. Der elektronische Gesamtzustand wird üblicherweise in der Form 2S + 1LJ (ohne explizite Angabe von mJ) notiert.
wie oben beschrieben. Der elektronische Gesamtzustand wird üblicherweise in der Form 2S + 1LJ (ohne explizite Angabe von mJ) notiert.Die Russell-Saunders-Kopplung ist nach Henry Norris Russell (1877-1957) und Frederick Albert Saunders (1875-1963) benannt. Sie publizierten ihre Arbeit New Regularities in the Spectra of the Alkaline Earths im Astrophysical Journal 61 (1925) 38.
Die Regeln
Die hier vorgenommene Einteilung in vier Regeln ist konsistent mit den verbreiteten Lehrbüchern der Atomphysik. Allerdings findet man besonders in älteren Büchern auch weniger, meist zwei, Hundsche Regeln, die dann der 2. und 3. hier aufgeführten Regel entsprechen. Eine Begründung für die 2. und 3. Regel liefert die Austauschwechselwirkung.
Erste Hundsche Regel
„Volle Schalen und Unterschalen haben den Gesamtdrehimpuls Null.“
Diese Regel ergibt sich direkt aus dem Pauli-Prinzip. Für eine gefüllte Schale müssen alle möglichen Quantenzahlen belegt sein, daher gibt es gleich viele positive wie negative Orientierungen der Bahndrehimpulse und Spins der Elektronen. Der resultierende Gesamtdrehimpuls
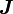 , sowie die zugehörigen Quantenzahlen J,mJ können nur den Wert Null haben. Konsequenterweise müssen also nur die nicht abgeschlossenen Schalen bei der Berechnung von
, sowie die zugehörigen Quantenzahlen J,mJ können nur den Wert Null haben. Konsequenterweise müssen also nur die nicht abgeschlossenen Schalen bei der Berechnung von 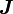 berücksichtigt werden. Streng gesehen ergibt sich diese Tatsache auch als Folge aus den weiteren Regeln, da sie aber ein wichtiges Resultat darstellt, wird sie häufig als eigene Regel ausgeführt.
berücksichtigt werden. Streng gesehen ergibt sich diese Tatsache auch als Folge aus den weiteren Regeln, da sie aber ein wichtiges Resultat darstellt, wird sie häufig als eigene Regel ausgeführt.Zweite Hundsche Regel
„Der Gesamtspin
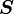 nimmt den maximal möglichen Wert an, die Spins der einzelnen Elektronen
nimmt den maximal möglichen Wert an, die Spins der einzelnen Elektronen 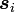 stehen also möglichst parallel.“
stehen also möglichst parallel.“Erläuterung. Um dieser Regel gerecht zu werden, müssen den Elektronen zunächst unterschiedliche Werte für die magnetische Quantenzahl ml vergeben werden, damit im Einklang mit dem Pauli-Prinzip gleiche Spinquantenzahlen möglich sind. Es gibt 2l + 1 verschiedene Werte für ml, daher kann die Gesamtspinquantenzahl S maximal den Wert
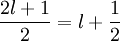 annehmen. Dieser Wert wird erreicht, wenn die Schale genau zur Hälfte gefüllt ist. Bei größerer Befüllung müssen wegen des Pauli-Prinzips die Spins der Elektronen antiparallel zu denen der bereits verbauten Elektronen stehen.
annehmen. Dieser Wert wird erreicht, wenn die Schale genau zur Hälfte gefüllt ist. Bei größerer Befüllung müssen wegen des Pauli-Prinzips die Spins der Elektronen antiparallel zu denen der bereits verbauten Elektronen stehen.Hintergrund. Wegen des Pauli-Prinzips muss die Wellenfunktion der Elektronen total antisymmetrisch sein. Parallel stehende Spins bedeuten einen symmetrischen Spinanteil der Wellenfunktion. Die Antisymmetrie muss dann vom Bahnanteil herrühren. Ein antisymmetrischer Bahnanteil beschreibt aber einen Zustand, bei dem die Elektronen möglichst weit voneinander entfernt sind. Diese Eigenschaft sorgt für eine kleine (Coulomb-)Wechselwirkungsenergie. Da diese nach Voraussetzung größer als die der Spin-Bahn-Kopplung ist, ist der Zustand mit möglichst vielen parallelen Spins auch der mit der niedrigsten Energie.
Dritte Hundsche Regel
„Erlaubt das Pauli-Prinzip mehrere Konstellationen mit maximalem Gesamtspin
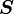 , dann werden die Unterzustände mit der Quantenzahl ml so besetzt, dass der Gesamt-Bahndrehimpuls
, dann werden die Unterzustände mit der Quantenzahl ml so besetzt, dass der Gesamt-Bahndrehimpuls 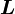 maximal wird.“
maximal wird.“Erläuterung. Nach dieser Regel wird das erste Elektron einer neuen Schale den maximalen Wert von | ml | = l annehmen. Das zweite Elektron darf wegen des Pauli-Prinzips und der zweiten Regel nicht denselben Wert für ml bekommen, bekommt also den zweitgrößten Wert l − 1. Die Gesamtdrehimpuls-Quantenzahl L lautet für diesen Fall damit L = l + (l − 1) = 2l − 1. Ist die Schale halbgefüllt, so müssen nach der zweiten Regel alle ml einmal vergeben sein, L ist hier also gleich Null. Bei der Befüllung der zweiten Hälfte werden dann die ml nach der gleichen Reihenfolge wie bei Befüllung der ersten Hälfte vergeben.
Hintergrund. Im Einteilchenfall wächst der mittlere Abstand eines Elektrons vom Kern mit der Quantenzahl ml , der z-Komponente des Drehimpulses. Da Elektronen, die weit vom Kern entfernt sind, tendenziell auch weit voneinander entfernt sind, wird (wie im Falle der Zweiten Hundschen Regel) die Coulomb-Wechselwirkung klein. Der Effekt ist aber kleiner als der durch parallele Spins. Deshalb hat die Zweite Hundsche Regel auch Vorrang vor der Dritten.
Vierte Hundsche Regel
„Ist eine Unterschale höchstens zur Hälfte gefüllt, dann ist der Zustand mit minimaler Gesamtdrehimpulsquantenzahl J am stärksten gebunden. Bei mehr als halbvollen Unterschalen ist es umgekehrt.“
Erläuterung. Nach der zweiten und dritten Regel werden die Quantenzahlen für Gesamtspin und Gesamtbahndrehimpuls festgelegt. Für den Gesamtdrehimpuls verbleiben daher noch alle ganzzahligen Werte zwischen | L − S | und L + S. Nach dieser Regel wird festgelegt, dass J sich immer wie folgt berechnet:
- Ist die Schale weniger als halbvoll, so ist J = | L − S |
- Ist die Schale mehr als halbvoll, so ist J = L + S
Sollte die Schale genau halbgefüllt sein, so ist nach der dritten Regel L = 0, daher ergeben beide Rechnungen den gleichen Wert.
Diese Regel braucht nicht betrachtet zu werden, wenn man nur an der Verteilung von ml,ms für die Elektronen einer Schale interessiert ist. Für das magnetische Verhalten der Atome ist aber die Gesamtkonfiguration der Elektronen und damit der Gesamtdrehimpuls entscheidend.
Hundsche Regel in der Chemie
In der Chemie wird oft nur eine einzige Hundsche Regel verwendet, die 1927 von Friedrich Hund selbst rein empirisch gefunden wurde und inhaltlich der zweiten der oben aufgeführten Regeln entspricht. Sie besagt, wenn für die Elektronen eines Atoms mehrere Orbitale/Nebenquanten mit gleichem Energieniveau zur Verfügung stehen, werden diese zuerst mit je einem Elektron mit parallelem Spin besetzt. Erst wenn alle Orbitale des gleichen Energieniveaus mit jeweils einem Elektron gefüllt sind, werden sie durch das zweite Elektron vervollständigt.
Die Unterscheidung der "Hundschen Regel" in der Chemie von den "Hundschen Regeln" in der Physik bezieht sich nur auf die Nomenklatur – selbstverständlich gelten in Chemie und Physik dieselben Regeln und Gesetzmäßigkeiten.
Da die Hundsche Regel die Lage der zu einer bestimmten Konfiguration der Elektronen gehörenden Terme beschreibt, hat sie Einfluss auf das chemische Verhalten von Atomen.
Eine durch einen starken Liganden verursachte Elektronenkonfiguration, die nicht der Hundschen Regel entspricht, wird als magnetisch anomal oder als low spin bezeichnet.
Anwendung
Legende l s,p,d,f,...
( = 0,1,2,3,...)Nebenquantenzahl ml − l,...,l Magnetische Quantenzahl ms ↑,↓
( = ½,−½)Spinquantenzahl S Gesamtspin Quantenzahl L S,P,D,F,...
( = 0,1,2,3,...)Gesamtbahndrehimpuls Quantenzahl J Gesamtdrehimpuls Quantenzahl e − ml S L J 2 1 0 −1 −2 Σms | Σml | s-Schale (l = 0) s1 ↑ ½ 0 ½ s2 ↑↓ 0 0 0 p-Schale (l = 1) p1 ↑ ½ 1 ½ p2 ↑ ↑ 1 1 0 p3 ↑ ↑ ↑ 1½ 0 1½ p4 ↑↓ ↑ ↑ 1 1 2 p5 ↑↓ ↑↓ ↑ ½ 1 1½ p6 ↑↓ ↑↓ ↑↓ 0 0 0 d-Schale (l = 2) d1 ↑ ½ 2 1½ d2 ↑ ↑ 1 3 2 d3 ↑ ↑ ↑ 1½ 3 1½ d4 ↑ ↑ ↑ ↑ 2 2 0 d5 ↑ ↑ ↑ ↑ ↑ 2½ 0 2½ d6 ↑↓ ↑ ↑ ↑ ↑ 2 2 4 d7 ↑↓ ↑↓ ↑ ↑ ↑ 1½ 3 4½ d8 ↑↓ ↑↓ ↑↓ ↑ ↑ 1 3 4 d9 ↑↓ ↑↓ ↑↓ ↑↓ ↑ ½ 2 2½ d10 ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ 0 0 0 Beispiel. Gesucht ist der Grundzustand eines Atoms mit 8 Elektronen auf der 3d-Schale in der 4. Periode (das Element Nickel). Die Schale hat Platz für 10 Elektronen, 5 davon mit Spin ↑, die anderen mit Spin ↓. Nach der ersten Hundschen Regel liefern die vollbesetzten inneren Schalen keinen Beitrag und brauchen nicht betrachtet zu werden.
Da nach der zweiten Hundschen Regel die Spinquantenzahl S = Σms maximal sein muss, werden zunächst alle 5 Plätze mit Spin ↑ besetzt. Die restlichen 3 Elektronen müssen dann Spin ↓ haben. Der Gesamtspin ergibt sich damit zu S = 1 (entsprechend 2 ungepaarten Spins).
Laut der dritten Hundschen Regel muss L = Σml maximal sein. Die verbleibenden Spin ↓-Elektronen besetzen demnach die Zustände ml = 2,1,0. Insgesamt wird L = 3.
Den Gesamtdrehimpuls liefert schließlich die vierte Hundsche Regel. Da die Schale mehr als halbvoll ist, gilt J = L + S, hier also gleich J = 4.
Der elektronische Gesamtzustand ist damit durch 3F4 charakterisiert.
Siehe auch
- Atommodell, Elektronenkonfiguration, Pauli-Prinzip, Periodensystem
- Magnetische Quantenzahl und Spinquantenzahl, siehe Nebenquantenzahl
Wikimedia Foundation.
