- Iodmethan
-
Strukturformel 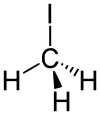
Allgemeines Name Iodmethan Andere Namen - Methyliodid
- Monoiodomethan
- Halon 10001
Summenformel CH3I CAS-Nummer 74-88-4 PubChem 6328 Kurzbeschreibung farblose, stechend etherisch riechende Flüssigkeit[1]
Eigenschaften Molare Masse 141,94 g·mol−1 Aggregatzustand flüssig
Dichte 2,27 g·cm−3[1]
Schmelzpunkt Siedepunkt 42 °C[1]
Dampfdruck Löslichkeit schlecht in Wasser (14 g·l−1 bei 20 °C)[1]
Brechungsindex 1,5304[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 

Gefahr
H- und P-Sätze H: 351-312-331-301-335-315 EUH: keine EUH-Sätze P: 261-280-301+310-311 [4] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Giftig (T) R- und S-Sätze R: 23/25-21-37/38-40 S: (1/2)-36/37-38-45 MAK aufgehoben, da Verdacht auf krebserzeugende Wirkung[1]
LD50 76 mg·kg−1 (Ratte, peroral)[2]
Thermodynamische Eigenschaften ΔHf0 −13,6 ± 0,5 kJ·mol−1[5]
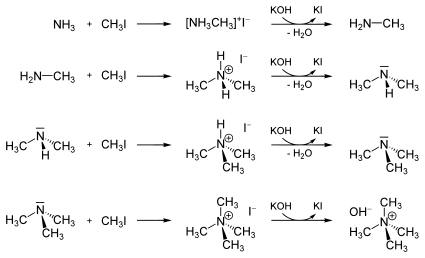
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C Iodmethan, veraltet Methyliodid ist eine farblose, etherisch riechende Flüssigkeit. Sie hat sich im Tierversuch als krebserregend erwiesen.[6] Iodmethan reagiert mit Alkali- und Erdalkalimetallen und wird zur Methylierung (Einführung einer Methylgruppe) von organischen Substanzen verwendet. Ammoniak und Amine reagieren mit Iodmethan unter Bildung von Ammoniumiodiden. Durch Wiederholung dieser Reaktion können quartäre Ammoniumionen erzeugt werden, wobei nach jedem Schritt das Amin mit einer Base freigesetzt wird:
Quartäre Ammoniumionen können nicht mehr durch Laugen deprotoniert werden. Ihre Salze sind vollständig dissoziiert.
Darstellung
Methyliodid entsteht in einer exothermen Reaktion, wenn Iod zu einem Gemisch von Methanol und rotem Phosphor gegeben wird.[7] Das iodierende Reagenz ist Phosphortriiodid, das in situ gebildet wird:
Alternativ kann Methyliodid durch Reaktion von Dimethylsulfat mit Kaliumiodid in Gegenwart von Calciumcarbonat hergestellt werden:[7]
Methyliodid/CH3I kann durch Destillation und nachfolgendes Waschen mit Na2S2O3 von Iod gereinigt werden.
Physiologische Wirkung
Methyliodid ist wie andere Methylierungsreagenzien (Beispiel: Dimethylsulfat) krebserregend und sehr toxisch. Die kanzerogene Wirkung ist ursächlich verbunden mit der methylierenden Wirkung. Methyliodid ist ein sehr gutes Elektrophil und geht somit leicht nucleophile Substitutionsreaktionen mit körpereigenen Nucleophilen ein. Dadurch kommt es zu einer Methylierung der DNA, die dann bei der Zellteilung nicht mehr korrekt von der DNA-Polymerase abgelesen werden kann.[8]
Einzelnachweise
- ↑ a b c d e f g Eintrag zu CAS-Nr. 74-88-4 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13. Januar 2008 (JavaScript erforderlich).
- ↑ a b Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ a b Eintrag zu CAS-Nr. 74-88-4 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Datenblatt Iodomethane bei Sigma-Aldrich, abgerufen am 5. April 2011.
- ↑ A. S. Carson, P. G. Laye, J. B. Pedley, Alison M. Welsby: The enthalpies of formation of iodomethane, diiodomethane, triiodomethane, and tetraiodomethane by rotating combustion calorimetry, in: The Journal of Chemical Thermodynamics, 1993, 25 (2), S. 261–269; doi:10.1006/jcht.1993.1025.
- ↑ Thieme Chemistry (Hrsg.): RÖMPP Online – Version 3.11. Georg Thieme Verlag KG, Stuttgart 2011.
- ↑ a b C. S. King, W. W. Hartman: Methyl Iodide, in: Organic Synthesis, 1943, 2, S. 399 (Artikel).
- ↑ Carsten Schmuck, Bernd Engels, Tanja Schirmeister, Reinhold Fink: Chemie für Mediziner, Pearson Studium, S. 457, ISBN 978-3-8273-7286-4.
Kategorien:- Stoff mit Verdacht auf krebserzeugende Wirkung
- Gesundheitsschädlicher Stoff
- Giftiger Stoff
- Iodalkan
Wikimedia Foundation.