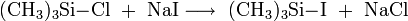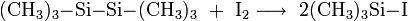- Iodtrimethylsilan
-
Strukturformel 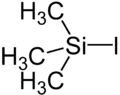
Allgemeines Name Trimethylsilyliodid Andere Namen Iodtrimethylsilan
Summenformel C3H9ISi CAS-Nummer 16029-98-4 Kurzbeschreibung orangefarbene bis bräunliche Flüssigkeit mit stechendem Geruch[1] Eigenschaften Molare Masse 200,09 g/mol Aggregatzustand flüssig
Dichte 1,47 g/cm3[1]
Siedepunkt Löslichkeit Zersetzung mit Wasser[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 

Leicht-
entzündlichÄtzend (F) (C) R- und S-Sätze R: 11-14-34 S: 7/9-16-26-36/37/39-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Trimethylsilyliodid ist eine chemische Verbindung. Sie besteht aus einem zentralen Siliciumatom, das nahezu tetraedrisch von drei Methylresten und einem Iodsubstituenten umgeben ist.
Inhaltsverzeichnis
Herstellung
Trimethylsilyliodid kann in einer Finkelstein-ähnlichen Reaktion durch die Umsetzung von Trimethylsilylchlorid mit Natriumiodid[2] oder Magnesiumiodid[3] erhalten werden.
Eine weitere Möglichkeit besteht in der Spaltung von Hexamethyldisilan[4] oder Hexamethyldisiloxan[5] durch Iod.
Eigenschaften
Trimethylsilyliodid ist eine orangefarbene bis bräunliche Flüssigkeit, die bei 107 °C siedet. Der Brechungsindex beträgt bei 20 °C und einer Wellenlänge von 589 nm 1,471.[6]
Verwendung
Trimethylsilyliodid kann zur Synthese von Eschenmosersalz genutzt werden. Hierzu wird es mit Tetra-N-methylmethandiamin zur Reaktion gebracht.[7]
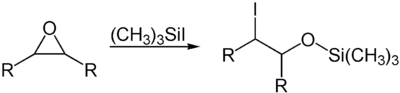
Durch seine Lewis-sauren Eigenschaften kann es auch zur Öffnung von sauerstoffhaltigen Heterocyclen genutzt werden. Ein Beispiel hierfür ist die Öffnung von Epoxiden.[8]
Quellen
- ↑ a b c d e Sicherheitsdatenblatt Merck
- ↑ C. Paolucci, L. Mattioli: Stereoisomeric Sugar-Derived Indolizines as Versatile Building Blocks: Synthesis of Enantiopure Di- and Tetrahydroxyindolizidines, in: J. Org. Chem. 2001, 66, 4787–4794. doi:10.1021/jo0016428
- ↑ U. Krüerke: Halogen-Austausch an Chlorsilanen und die Tetrahydrofuran-Spaltung durch Brom-und Jodsilane, in: Chem. Ber. 1962, 95, 174–182. doi:10.1002/cber.19620950128
- ↑ E. C. Friedrich, C. B. Abma, P. F. Vartanian: Metal-halogen bonding studies with group IV A trialkylmetal halides, in: J. Organomet. Chem. 1980, 187, 203-211. ISSN 0022-328X, doi:10.1016/S0022-328X(00)81789-1
- ↑ M. E. Jung, M. A. Lyster: Quantitative dealkylation of alkyl ethers via treatment with trimethylsilyl iodide. A new method for ether hydrolysis, in: J. Org. Chem. 1977, 42, 3761–3764. doi:10.1021/jo00443a033
- ↑ Sicherheitsdatenblatt Sigma-Aldrich
- ↑ T. A. Bryson, G. H. Bonitz, C. J. Reichel, R. E. Dardis: Performed Mannich salts: a facile preparation of dimethyl(methylene)ammonium iodide, in: J. Org. Chem. 1980, 45, 524–525. doi:10.1021/jo01291a032
- ↑ H. Poleschner, M. Heydenreich, D. Martin: Cyclische Ether als Edukte zur Synthese von Schmetterlings-Pheromonen, in: Synthesis 1991, 12, 1231–1235. doi:10.1055/s-1991-28425
Wikimedia Foundation.