- Kaliumferrat
-
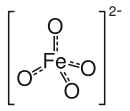
Strukturformel 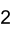
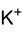
Allgemeines Name Kaliumferrat Andere Namen Kaliumferrat(VI)
Summenformel K2FeO4 CAS-Nummer 39469-86-8 Kurzbeschreibung schwarzer Feststoff [1]
Eigenschaften Molare Masse 198,04 g·mol−1 Aggregatzustand fest
Schmelzpunkt Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 
Gefahr
H- und P-Sätze H: 272 EUH: keine EUH-Sätze P: 220 [1] EU-Gefahrstoffkennzeichnung [1] 
Brand-
fördernd(O) R- und S-Sätze R: 8 S: 17-36 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kaliumferrat(VI) ist eine purpurrote bis violette, in reiner Form stabile chemische Verbindung.
Das Ferrat(VI)-Ion (FeVIO42−) enthält ein tetraedisch von vier Sauerstoffatomen umgebenes Eisenatom. Es handelt sich um einen Charge-Transfer-Komplex, wodurch die intensive Färbung erklärt wird.
In dieser Verbindung liegt Eisen in seiner höchsten vorkommenden Oxidationsstufe vor. Kaliumferrat ist daher ein starkes Oxidationsmittel, stärker als Kaliumpermanganat.
Inhaltsverzeichnis
Gewinnung
Man erhält Kaliumferrat durch Einbringen von wässriger Eisen(III)-nitrat-Lösung in gesättigter Kalilauge (Kaliumhydroxid-Lösung) und anschließende Oxidation durch Einleiten von Chlorgas. Das Chlor agiert dabei als Hypochlorit:
Das so gewonnene Produkt enthält allerdings bis zu 50 Prozent Verunreinigungen, wodurch die Verbindung instabil wird und nach kurzer Zeit in die Oxide zerfällt. Es lässt sich so auch nur in Lösung weiterverarbeiten.
Eine neuere Methode benutzt statt des Chlors Kaliumperoxosulfat als Oxidationsmittel.
Eigenschaften
Kaliumferrat kristallisiert in einer orthorhombischen Kristallstruktur mit der Raumgruppe Pnam. Die Gitterkonstanten sind a=76,9 pm, b=103,3 pm und c=58,6 pm. Die Struktur ist isomorph zu der von Kaliumsulfat und Kaliumchromat.[2]
Einzelnachweise
- ↑ a b c d e Datenblatt Potassium ferrate(VI) bei Sigma-Aldrich, abgerufen am 6. April 2011.
- ↑ M. L. Hoppe, E. O. Schlemper, R. K. Murmann: Structure of Dipotassium Ferrate(Vl), in: Act. Cryst., 1982, B38, 2237–2239, doi:10.1107/S0567740882008395
Weblinks
Wikimedia Foundation.


