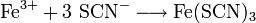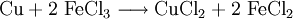- Eisensalz
-
Eigenschaften Allgemein Name, Symbol, Ordnungszahl Eisen, Fe, 26 Serie Übergangsmetalle Gruppe, Periode, Block 8, 4, d Aussehen metallisch glänzend mit
einem gräulichen FarbtonCAS-Nummer 7439-89-6 Massenanteil an der Erdhülle 4,7[1] % Atomar Atommasse 55,845 u Atomradius (berechnet) 140 (156) pm Kovalenter Radius 125 pm Elektronenkonfiguration [Ar] 3d64s2 Elektronen pro Energieniveau 2, 8, 14, 2 Austrittsarbeit 4,31 − 4,5 eV 1. Ionisierungsenergie 762,5 kJ/mol 2. Ionisierungsenergie 1561,9 kJ/mol 3. Ionisierungsenergie 2957 kJ/mol 4. Ionisierungsenergie 5290 kJ/mol Physikalisch Aggregatzustand fest Kristallstruktur kubisch raumzentriert Dichte 7,874 g/cm3 Mohshärte 4,0 Magnetismus ferromagnetisch Schmelzpunkt 1808 K (1535 °C) Siedepunkt 3023 K (2750 °C) Molares Volumen 7,09 · 10−6 m3/mol Verdampfungswärme 349,6 kJ/mol Schmelzwärme 13,8 kJ/mol Dampfdruck 7,05 Pa bei 1808 K Schallgeschwindigkeit ~5900 m/s(long.)
~3200 (trans.) m/s bei 293,15 KSpezifische Wärmekapazität 452 J/(kg · K) Elektrische Leitfähigkeit 9,93 · 106 A/(V · m) Wärmeleitfähigkeit 80,2 W/(m · K) Chemisch Oxidationszustände 2, 3, 4, 6 Oxide (Basizität) (amphoter) Normalpotential −0,447 V (Fe2+ + 2e− → Fe) Elektronegativität 1,83 (Pauling-Skala) Isotope Isotop NH t1/2 ZM ZE MeV ZP 52Fe 8,275 h ε 2,372 52Mn 53Fe 8,51 min ε 3,743 53Mn 54Fe 5,8 %
Stabil 55Fe 2,73 a ε 0,231 55Mn 56Fe 91,72 %
Stabil 57Fe 2,2 %
Stabil 58Fe 0,28 %
Stabil 59Fe 44,503 d β− 1,565 59Co 60Fe 1,5 · 106 a β− 3,978 60Co NMR-Eigenschaften Sicherheitshinweise Gefahrstoffkennzeichnung [2] 
Leicht-
entzündlich(F) (Pulver)R- und S-Sätze R: 11 (Pulver) S: 53-45-60-61 (Pulver) Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.Eisen (mhd. isen; vergleichbar mit kelt. isara „kräftig“, got. eisarn und aiz, lat. aes „Erz“)[A 1] ist ein chemisches Element im Periodensystem der Elemente mit Symbol Fe (lat. ferrum, Eisen) und Ordnungszahl 26. Es ist ein Metall der 4. Periode in der 8. Nebengruppe im Periodensystem. Im Kontext der industriellen Fertigung versteht man unter Eisen den Werkstoff Gusseisen, wohingegen der Werkstoff Stahl gewöhnlich nicht als Eisen bezeichnet wird.
Inhaltsverzeichnis
Geschichte
Naher Osten
Die erste nachweisbare Nutzung von Eisen findet sich etwa um 4000 v. Chr. in Sumer und Ägypten. Es handelte sich um gediegenes Eisen von Meteoriten, das zur Dekoration und zur Anfertigung von Speerspitzen diente.
Aus dem Zeitraum zwischen 3000 und 2000 v. Chr. findet man verhüttetes Eisen (vom Meteoriteisen durch die Abwesenheit von Nickel unterscheidbar) in Mesopotamien, Anatolien und Ägypten. Es scheint nur zeremoniell genutzt worden zu sein und war wertvoller als Gold. Möglicherweise entstand es in Form von Eisenschwamm als Nebenprodukt der Bronzeherstellung.
Zwischen 1600 und 1200 v. Chr. wurde Eisen verstärkt genutzt; die Hethiter kannten wohl eine Methode zur wirtschaftlichen Herstellung von Eisen. Es löste Bronze allerdings noch nicht ab. In dieser Zeit blieb die Eisenproduktion weitgehend ein Monopol des Hethitischen Reiches (auf dem Gebiet der heutigen Türkei) und war ein Faktor dessen Aufstiegs. Ab 1200 v. Chr. fand mit dem Untergang des Hethitischen Reiches und der Verbreitung des entsprechenden Wissens im Nahen Osten der Übergang von der Bronzezeit zur Eisenzeit statt. Die Überlegenheit eiserner Rüstungen und Waffen gegenüber bronzener Ausrüstung wird hierfür als der wesentliche Grund angesehen. Es gibt allerdings Vermutungen, dass nicht nur die Materialüberlegenheit des Eisens, sondern auch ein Mangel an Zinn, das zur Bronzeherstellung benötigt wird, dem Übergang Vorschub leistete.
Beim ersten eisenzeitlichen Verhüttungsschritt entstand Eisenschwamm. Durch den Gebrauch von Holzkohle bei der Weiterverarbeitung wurde dem Eisen Kohlenstoff zugeführt, mit dem Endresultat eines (zumindest oberflächlichen) Stahls. Durch vorsichtiges Härten (das heißt sorgfältiges und gekonntes Abkühlen, im Allgemeinen in einer Flüssigkeit wie Wasser oder Öl) entstanden Werkstücke mit einer bis dahin nicht gekannten Elastizität und Härte, die der Bronze weit überlegen waren.
China
Auch in China wurden die ersten Erfahrungen mit Eisen an Meteoriteneisen gewonnen. Erste archäologische Spuren von Schmiedeeisen finden sich im Nordwesten, nahe Xinjiang, aus dem 8. vorchristlichen Jahrhundert. Man vermutet, dass diese Produkte, die mit den Methoden des Nahen Ostens erstellt wurden, durch Handel nach China gelangt sind.
550 v. Chr. wurde der Hochofen entwickelt: Jetzt war das Herstellen von Gusseisen möglich.
Europa
Neben seiner herausragenden Bedeutung als Werkstoff wurde Eisen in der Alchemie verwendet, wo es mit dem Zeichen für Mars/Männlichkeit ♂ assoziiert wurde.
Da europäische Verarbeitungstechniken (Rennofen) nur Temperaturen von knapp 1.300 °C erreichten, fand die Entwicklung von Gusseisen erst im 15. Jahrhundert in Schweden (Lapphyttan und Vinarhyttan) statt. Mit der gegossenen Kanonenkugel verbreitete sich die Gusseisenverarbeitung schnell wie die Feldzüge über ganz Europa.
Als die schwindenden Wälder den wachsenden Holzkohlebedarf zur Eisengewinnung in Großbritannien nicht mehr decken konnten, wurde Kohle (genauer das Kohleprodukt Koks) von Abraham Darby als Alternative entwickelt. Diese Umstellung, zusammen mit der Erfindung der Dampfmaschine, gilt als Beginn der industriellen Revolution.
Eisenfunde
Eisenfunde sind gegenüber den Funden von Bronze relativ selten, einerseits weil das Eisen in den ältesten Perioden nur in geringem Maße verwendet wurde, andererseits wegen der großen Neigung des Eisens, an feuchter Luft, im Wasser und in der nassen Erde zu korrodieren, wodurch die Gegenstände sich nicht erhalten konnten. Nur besondere Umstände oder große Ausmaße des Gegenstandes verhinderten den Verlust solcher Stücke.
Eines der ältesten Fundstücke stammt aus der Cheopspyramide und wurde 1837 von J. R. Hill beim Lossprengen einiger Steinlagen in einer Mauerfuge gefunden, wo es vor Rost geschützt war. Es handelt sich um das Bruchstück eines größeren schmiedeeisernen Werkzeugs und hat ein Alter von etwa 5.000 Jahren. Ein späteres Fundstück ist das von Belzoni unter einer Sphinx in Karnak entdeckte Stück, das als Teil einer Sichel erkannt wurde und etwa 2.800 Jahre alt ist.
In Asien fanden sich eiserne Gegenstände in den Gräbern von Turan und größere Eisenlager in den Ruinen von Khorsabad, wo Ringe, Kettenteile zusammen mit etwa 160.000 kg Eisenbarren entdeckt wurden. Auch Layard stieß bei seinen Ausgrabungen in Nimrud auf eiserne Waffen, wie Helme, Speere und Dolche. Berühmt ist die Eiserne Säule in Delhi, ein sieben Meter hoher schmiedeeiserner Pfeiler aus dem 4./5. Jahrhundert.
Zu den ältesten europäischen Stücken gehören die eisernen Zelte und Speere, die Graf Gozzadini 1853 in etruskischen Gräbern bei Bologna entdeckt hat. Sie stammen aus dem 9. bis 10. Jahrhundert vor Christus.
Vorkommen
Eisen steht in der Reihe der relativen Elementhäufigkeit bezogen auf Silizium im Universum mit 8,3 · 105 Atomen je 1 · 106 Siliziumatomen an 9. Stelle. Die Fusion von Elementen in Sternen endet beim Eisen, da bei der Fusion höherer Elemente keine Energie mehr frei wird, sondern aufgewendet werden muss (siehe Nukleosynthese). Schwerere Elemente entstehen endotherm bei Supernovaexplosionen, die auch für das Verstreuen der im Stern entstandenen Materie verantwortlich sind.
Eisen steht in der Reihe der Elementhäufigkeit nach dem Massenanteil an 2. Stelle in der gesamten Erde (28,8 %), an 4. Stelle in der Erdhülle (4,70 %) und an 4. Stelle in der kontinentalen Erdkruste (5,63 %); im Meerwasser ist es nur zu 0,002 mg/L enthalten. Eisen ist zusammen mit Nickel wahrscheinlich der Hauptbestandteil des Erdkerns. Vermutlich angetrieben von thermischen Kräften erzeugen Konvektionsströmungen von flüssigem Eisen im äußeren Kern das Erdmagnetfeld.
Die ersten Vorkommen, die abgebaut wurden, waren Raseneisenstein und offenliegende Erze. Heute wird vor allem 40-prozentiges Magneteisenerz abgebaut. Das wichtigste Mineral zur Eisengewinnung ist Hämatit, welches größtenteils aus Fe2O3 besteht. Die größten Eisenerzvorkommen finden sich in den sogenannten Banded Iron Formations (BIF, gebändertes Eisenerz oder Bändererz), die auch als Takonit oder Itabirit bezeichnet werden und Eisen hauptsächlich in den Mineralen Hämatit und Magnetit enthalten.
Eisen als Mineral
Sehr selten kommt Eisen gediegen vor. Das Mineral kristallisiert dann im kubischen Kristallsystem, hat eine Mohs-Härte von 4,5 und eine stahlgraue bis schwarze Farbe. Auch die Strichfarbe ist grau.
Wegen der Reaktion mit Wasser und Sauerstoff (Rosten) ist gediegenes Eisen nicht stabil. Es tritt daher in Legierung mit Nickel nur in Eisenmeteoriten auf sowie in Basalten, in denen es manchmal zu einer Reduktion von eisenhaltigen Mineralen kommt. Eisenerze findet man dagegen vergleichsweise häufig, wichtige Beispiele sind Magnetit (Fe3O4), Roteisenstein, Hämatit (Fe2O3), Brauneisenstein (Fe2O3·n H2O), Siderit (FeCO3), Magnetkies (FeS) und Pyrit (Eisenkies) (FeS2).
Staaten mit der größten Förderung
Weltweit wurden im Jahre 2000 etwa 1000 Mt (1 Milliarde Tonnen) Eisenerz abgebaut, mit einem Wert von etwa 25 Mrd. Euro. Die bedeutendsten erzliefernden Staaten sind Brasilien, Australien, die Volksrepublik China, Russland und Indien. Zusammen liefern sie etwa 70 % des Weltbedarfs. Aus den 1.000 Mt Erz wurden etwa 572 Mt Eisen gewonnen. Zusätzlich wird durch das Einschmelzen von Schrott Eisen zurück gewonnen.
Das bei weitem bedeutendste Herstellerland für Roheisen ist die Volksrepublik China, gefolgt von Japan und der Russischen Föderation. In Europa sind die wichtigsten Produzenten Ukraine und Deutschland.
Die größten Roheisenproduzenten weltweit (2003)
Quelle: Handelsblatt Die Welt in Zahlen (2005)Rang Land Produktion
(in Mio. t)Rang Land Produktion
(in Mio. t)1 VR China 202,3 10 Frankreich 13 2 Japan 82,1 11 Taiwan 10,3 3 Russische Föd. 48,3 12 Italien 10,1 4 Vereinigte Staaten 39,1 13 Vereinigtes Königreich 10,1 5 Brasilien 32 14 Kanada 8,5 6 Ukraine 29,6 15 Belgien 7,8 7 Deutschland 29,5 16 Südafrika 6,2 8 Südkorea 27,3 17 Australien 6,1 9 Indien 26,1 18 Niederlande 5,8 Für eine ausführlichere Liste der Produktionsländer siehe Liste der größten Roheisenerzeuger.
Gewinnung und Darstellung
 Eisenproduktion in Coalbrookdale, wo Abraham Darby I 1709 als erster Eisen unter Verwendung von Koks gewonnen hat (Gemälde von Philippe-Jacques de Loutherbourg, 1801)
Eisenproduktion in Coalbrookdale, wo Abraham Darby I 1709 als erster Eisen unter Verwendung von Koks gewonnen hat (Gemälde von Philippe-Jacques de Loutherbourg, 1801)Eisenerz wird im Tagebau und im Tiefbau (Untertagebau) gewonnen. Dort, wo die als abbauwürdig erkannten Eisenerzlagerstätten offen zutage treten, kann das Erz im weniger aufwändigen Tagebau gewonnen werden. Heute wird Eisenerz hauptsächlich in Südamerika, besonders Brasilien, im Westen Australiens, in der Volksrepublik China, in Ost-Europa (beispielsweise Ukraine) und Kanada auf diese Weise abgebaut.
Diese Länder verdrängten in den letzten Jahren die ursprünglich bedeutendsten Eisenerz-Förderländer wie Frankreich, Schweden und Deutschland, dessen letzte Eisenerzgrube in der Oberpfalz 1987 geschlossen wurde.
Riesige Erz-Abbaugebiete wie die Ok-Tedi-Mine in Papua-Neuguinea beeinträchtigen nicht nur den Regenwald stellenweise, sondern durch die Einleitung von ungeklärten Abwässern und Schlämmen in Flüsse teilweise auch diejenige Bevölkerung, die vom Flusswasser Gebrauch macht. Jedoch ist die Anzahl an Menschen, die durch die Mine in dem bitterarmen Land ihren Lebensunterhalt verdienen und oft sogar ihre Existenz verdanken, viel größer. Nur selten gelangt das Eisenerz vom Bergwerk kommend unmittelbar zu den Lagerplätzen der Eisenhütte. Meist müssen erst weite Transportwege auf dem Landweg und auf dem Seeweg, mit mehrfachem Umladen, zurückgelegt werden.
Nur ein kleiner Teil der Erze kann als Stückerz direkt im Hochofen eingesetzt werden. Der Hauptanteil der Eisenerze wird als Feinerz in einer Sinteranlage zu Sinter verarbeitet, denn nur in dieser Form als gesinterte grobe Brocken ist der Einsatz im Hochofen möglich, da das feine Erz die Luftzufuhr (Wind) sehr beeinträchtigen oder sogar verhindern würde. Gröbere Erzkörner werden nach ihrer Größe sortiert und gesintert. Kleine Erzkörner müssen dazu gemeinsam mit Kalkzuschlagsstoffen auf mit Gas unterfeuerte, motorisch angetriebene Wanderroste (Rost-Förderbänder) aufgebracht und durch starke Erhitzung angeschmolzen und dadurch „zusammengebacken“ (gesintert) werden. Sehr feines Erz wird pulverfein aufgemahlen, was oft bereits zur Abtrennung von Gangart nötigt ist. Dann wird es mit Kalkstein, feinkörnigem Koks (Koksgrus) und Wasser intensiv vermischt und auf einen motorisch angetriebenen Wanderrost aufgegeben. Durch den Wanderrost werden von unten Gase abgesaugt. Von oben wird angezündet und eine Brennfront wandert von oben nach unten durch die Mischung, die dabei kurz angeschmolzen (gesintert) wird. Ein wesentlicher Anteil der Erze wird jedoch zu Pellets verarbeitet. Hierzu wird mit Bindemitteln, Zuschlägen und Wasser eine Mischung erzeugt, die dann auf Pelletiertellern zu Kügelchen von 10 bis 16 mm Durchmesser gerollt wird. Diese werden auf einem Wanderrost mit Gasbefeuerung zu Pellets gebrannt. Sinter ist nicht gut transportierbar und wird deshalb im Hüttenwerk erzeugt, Pelletanlagen werden meist in der Nähe der Erzgruben betrieben.
Hochofenprozess
Das Eisen wird durch chemische Reduktion des Eisenoxids der Eisenerze mit Kohlenstoff im Hochofen gewonnen. Der Hochofen ist ein Schachtofen. Koks und Erz werden abwechselnd in Lagen oben in den Ofen hineingeschüttet. Dazu sind oberhalb des Ofengefäßes i.d.R. zwei Bunker angeordnet, die als Gasschleusen zwischen dem Ofengefäß und der Umgebung dienen. Ganz oben befindet sich innerhalb des Ofengefäßes eine Drehschurre, mit der das Material spiralförmig flächig auf der Beschickungsoberfläche verteilt wird. Die Kokslagen halten im unteren Bereich des Ofens, wenn das Erz plastisch wird, die Durchströmbarkeit der Schüttung mit Prozessgas aufrecht (Koksfenster).
Der Einsatz sinkt im Ofenschacht ab und wird dabei durch das aufsteigende Prozessgas getrocknet, aufgeheizt, reduziert und schließlich geschmolzen (Redoxreaktion). Der gesamte Vorgang dauert etwa acht Stunden. Das Prozessgas wird erzeugt, indem unten in den Ofen durch wassergekühlte Kupferdüsen (Blasformen) auf etwa 1200 °C vorgeheizte Luft eingeblasen wird. Der Sauerstoff der Luft verbrennt mit Koks zu Kohlenstoffmonoxid, wodurch das etwa 2000 °C heiße aus Kohlenstoffmonoxid und Stickstoff bestehende Prozessgas erzeugt wird, welches die Eisenoxide reduziert. Das hiervon übrig bleibende Abgas, das am oberen Ende des Ofenschachtes gewonnen wird, ist brennbar und wird zum Vorheizen der Luft verwendet. Mit Überschussgas wird in einem Kraftwerk Strom erzeugt.
Der Ofen erzeugt neben dem flüssigen Eisen flüssige Schlacke. Beides wird vermischt mit einer Temperatur von etwa 1450 °C durch ein Stichloch abgezogen, das etwa alle zwei Stunden durch Anbohren geöffnet und jeweils nach etwa einer Stunde durch Verstopfen mit einer keramischen Masse verschlossen wird. Eisen und Schlacke werden außerhalb des Ofens getrennt. Das Eisen wird in Transportpfannen gefüllt und ins Stahlwerk gebracht. Das Eisen ist bei 1450 °C flüssig, da durch den im Eisen gelösten Kohlenstoff eine Schmelzpunktserniedrigung erfolgt. Die Schlacke wird mit Wasser verdüst. Dabei erstarrt sie durch das Abschrecken als feinkörniges Glas (Schlackensand). Dieser Schlackensand wird fein gemahlen und als Zement verwendet. Ein Hochofen erzeugt pro Tonne Eisen etwa 200 bis 300 kg Schlacke.
Erz und Koks enthalten als Hauptverunreinigung Siliziumdioxid (Quarzsand, Silikate) SiO2 und Aluminiumoxid Al2O3. Ein kleiner Teil des Siliziumdioxids wird zu Silizium reduziert, das im Eisen gelöst wird. Der Rest bildet zusammen mit dem Aluminiumoxid die Schlacke (Aluminiumsilikate).
Da der Schmelzpunkt eines Gemisches von SiO2 und Al2O3 zu hoch ist, um eine bei 1450 °C flüssige Schlacke zu bilden, wird Calciumoxid (Gebrannter Kalk, CaO) zur Schmelzpunktserniedrigung verwendet. Dies wird meist bereits bei der Herstellung des Eisenerzsinters als Kalkstein zugegeben.
Das Eisen des Hochofens (Roheisen) hat nur einen Eisengehalt von etwa 95 %. Es enthält für die meisten Anwendungen zu viel Kohlenstoff, Schwefel, Silicium und Phosphor. Üblicherweise wird daher im Stahlwerk zunächst durch Einblasen von Calciumcarbid, Magnesium oder Branntkalk reduzierend entschwefelt. Die Entschwefelungsschlacke wird abgezogen und das Roheisen dann in einem Konverter (Sauerstoffblasverfahren) unter Zusatz von Branntkalk oxidierend verblasen. Dabei wird Silicium zu Siliciumdioxid und Kohlenstoff zu Kohlenstoffdioxid verbrannt. Der Phosphor wird als Calciumphosphat gebunden. Das flüssige Eisen hat danach eine Temperatur von etwa 1600 °C. Es enthält soviel Sauerstoff, dass beim Erstarren aus verbliebenem Kohlenstoff Kohlenmonoxidblasen entstehen. Beim heute meist verwendeten Strangguss ist dies unerwünscht. Beim Abstechen des Stahls aus dem Konverter in die Gießpfanne wird daher Aluminium zugegeben, um den Sauerstoff als Aluminiumoxid zu binden. Bei hohen Anforderungen an die Qualität des Stahls folgen auf den Konverterprozess noch weitere Verfahrensschritte, wie z. B. eine Vakuumbehandlung (Sekundärmetallurgie).
Eigenschaften
Das durchschnittliche Eisenatom hat etwa die 56-fache Masse eines Wasserstoffatoms. Der Atomkern des Eisenisotops 56Fe weist einen der größten Massendefekte und damit eine der höchsten Bindungsenergien pro Nukleon aller Atomkerne auf. Deshalb wird es als Endstufe bei der Energieerzeugung durch Kernfusion in den Sternen betrachtet.
Bei Raumtemperatur ist die allotrope Modifikation des reinen Eisens das Ferrit oder α-Eisen. Diese Modifikation weist ein kubisch raumzentriertes Kristallgitter auf, das unterhalb 911 °C vorliegt. Unterhalb des Curiepunkts bei 766 °C ist das Ferrit ferromagnetisch. Oberhalb des Curiepunkts ist es paramagnetisch. Diese paramagnetische Form wurde früher fälschlicherweise als „β-Modifikation“ von Eisen bezeichnet, da angenommen wurde, dass mit einer Änderung des Magnetismus auch eine Strukturänderung einhergeht. Heutzutage ist dagegen bekannt, dass bis 911 °C die α-Modifikation des Eisens vorliegt und darum ist die Bezeichnung „β-Eisen“ falsch.
Bis 1392 °C liegt es in der kubisch flächenzentrierten γ-Modifikation oder Austenit vor. Bei weiter steigender Temperatur wandelt das Eisen in δ-Ferrit um, das wieder ein kubisch raumzentriertes Gitter aufweist. Der Schmelzpunkt liegt bei 1535 °C.
Diese Eigenschaft der Umwandlung des Gitters von kubisch-raumzentriert (bis 911 °C) über kubisch-flächenzentriert (bis 1392 °C) zu kubisch-raumzentriert (bis 1539 °C) sowie des anschließenden Zerfalls der Gitterstrukturen nennt man auch die „Polymorphie des Eisens“.
Eisen ist beständig an trockener Luft, in trockenem Chlor sowie in konzentrierter Schwefelsäure, konzentrierter Salpetersäure und basischen Agenzien (außer heißer Natronlauge) mit einem pH-Wert größer als 9.
Isotope
Eisen hat vier natürlich vorkommende, stabile Isotope, mit den relativen Häufigkeiten: 54Fe (5,8 %), 56Fe (91,7 %), 57Fe (2,2 %) und 58Fe (0,3 %). Das Isotop 60Fe hat eine Halbwertszeit von 1,5 Millionen Jahren. Die Existenz von 60Fe zu Beginn der Entstehung des Planetensystems konnte durch den Nachweis einer Korrelation zwischen den Häufigkeiten von 60Ni, dem Zerfallsprodukt von 60Fe, und den Häufigkeiten der stabilen Fe-Isotope in einigen Phasen mancher Meteorite (beispielsweise in den Meteoriten Semarkona und Chervony Kut) nachgewiesen werden. Möglicherweise spielte die freigesetzte Energie beim radioaktiven Zerfall von 60Fe, neben der atomaren Zerfallsenergie des ebenfalls vorhandenen radioaktiven 26Al, eine Rolle beim Aufschmelzen und der Differenzierung der Asteroiden direkt nach ihrer Bildung vor etwa 4,6 Milliarden Jahren. Heute ist fast alles damals ursprünglich vorhanden gewesene 60Fe vollständig in 60Ni zerfallen. Die Verteilung von Nickel- und Eisenisotopen in Meteoriten erlaubt es, die Isotopen- und Elementehäufigkeit bei der Bildung des Sonnensystems zu messen und die vor und während der Bildung des Sonnensystems vorherrschenden Bedingungen zu erschließen.
Nur das Eisenisotop 57Fe besitzt einen Kernspin.
Verwendung
Eisen ist der Hauptbestandteil von Stahl. Stähle sind Legierungen des Eisens, die beim Vermischen (Legieren) mit anderen Metallen und auch Nichtmetallen (insbesondere Kohlenstoff) entstehen. Eisen ist mit 95 Prozent Gewichtsanteil an genutzten Metallen das weltweit meistverwendete. Der Grund dafür liegt in seiner weiten Verfügbarkeit, welche es recht preiswert macht, und darin, dass es hervorragende Festigkeit und Zähigkeit beim Eingehen von Legierungen mit anderen Metallen wie Chrom, Molybdän und Nickel, erreicht, die es für viele Bereiche in der Technik zu einem Grundwerkstoff machen. Es wird bei der Herstellung von Landfahrzeugen, Schiffen und im gesamten Baubereich (Stahlbeton) eingesetzt.
Eisen ist (neben Cobalt und Nickel) eines jener drei ferromagnetischen Metalle, die mit ihrer Eigenschaft den großtechnischen Einsatz des Elektromagnetismus u. a. in Generatoren, Transformatoren, Drosseln, Relais und Elektromotoren ermöglichen. Es wird rein oder u. a. mit Silicium, Aluminium, Kobalt oder Nickel (siehe Mu-Metall) legiert und dient als weichmagnetisches Kernmaterial zur Führung von Magnetfeldern, zur Abschirmung von Magnetfeldern oder zur Erhöhung der Induktivität. Es wird hierzu massiv und in Form von Blechen und Pulver (Pulverkerne) produziert.
Reines Eisenpulver wird auch in der Chemie verwendet.
Industriell sind verschiedene Stähle verbreitet; in Deutschland sind etwa 7.500 Sorten genormt. Eisen wird in den nachfolgend angeführten Formen genutzt:
- Roheisen enthält vier bis fünf Prozent Kohlenstoff sowie unterschiedliche Anteile an Schwefel, Phosphor und Silicium. Es ist ein Zwischenprodukt in der Herstellung von Gusseisen und Stahl.
- Gusseisen enthält 2,06 bis 6,67 % Kohlenstoff und weitere Legierungselemente, wie beispielsweise Silicium und Mangan. In Abhängigkeit von der Abkühlgeschwindigkeit liegt der Kohlenstoff im Gusseisen als Carbid oder elementar als Graphit vor. In Anlehnung an das Aussehen der Bruchflächen spricht man im ersten Fall von weißem und im zweiten Fall von grauem Gusseisen. Gusseisen ist sehr hart und spröde. Es lässt sich gewöhnlich nicht plastisch verformen.
- Stahl enthält zwischen 0,06 % und 2,06 % Kohlenstoff. Im Gegensatz zu Gusseisen ist er plastisch umformbar. Durch Legieren, sowie durch eine geeignete Kombination von thermischer Behandlung und plastischer Formung (Kaltwalzen) können die mechanischen Eigenschaften des Stahls in weiten Grenzen variiert werden.
- Bei unlegierten Stählen mit einem Kohlenstoffgehalt bis 0,8 % spricht man von Baustahl, bei über 0,8 % von Werkzeugstahl.
In der Medizin werden eisenhaltige Präparate als Antianämika eingesetzt, kausal in der Behandlung von Eisenmangelanämien und additiv in der Behandlung von durch andere Ursachen hervorgerufenen Anämien.
Geruch des Eisens
Der typische, als metallisch klassifizierte Geruch, wenn man Eisengegenstände berührt, entsteht durch eine chemische Reaktion von Stoffen des Schweißes und des Fetts der Haut mit zweiwertigen Eisenionen.[3]
Einer der wichtigsten Duftträger ist 1-Octen-3-on, das noch in großer Verdünnung pilzartig-metallisch riecht. Vorstufe der Geruchsstoffe sind Lipidperoxide. Diese entstehen, wenn Hautfett durch bestimmte Enzyme oder nichtenzymatische Prozesse (z. B. UV-Anteil des Lichts) oxidiert werden. Diese Lipidperoxide werden dann durch die zweiwertigen Eisenionen zersetzt, wobei die Duftstoffe gebildet werden. Die zweiwertigen Eisenionen entstehen durch Korrosion des Eisens bei Berührung mit dem Handschweiß, der korrosive organische Säuren und Chloride enthält.
Beim Verreiben von Blut auf der Haut entsteht ein ähnlicher Geruch. Blut enthält ebenfalls Eisenionen.
Biologische Bedeutung
Bestandteil von Lebewesen
Eisen ist ein essentielles Spurenelement für fast alle Lebewesen, bei Tieren vor allem für die Blutbildung. Im Körper liegt es oxidiert als Eisen(II) und Eisen(III) vor. Als Zentralatom des Kofaktors Häm b in Hämoglobin und Myoglobin und in Cytochromen ist es bei vielen Tieren und beim Menschen für Sauerstofftransport und -speicherung sowie für die Elektronenübertragung verantwortlich. In diesen Proteinen ist es von einem planaren Porphyrinring umgeben. Weiter ist Eisen Bestandteil von Eisen-Schwefel-Komplexen (so genannte Eisen-Schwefel-Cluster) in vielen Enzymen, beispielsweise Nitrogenasen, Hydrogenasen oder den Komplexen der Atmungskette. Als dritte wichtige Klasse der Eisenenzyme sind die so genannten Nicht-Häm-Eisenenzyme zu nennen, beispielsweise die Methan-Monooxygenase, Ribonukleotid-Reduktase und das Hämerythrin. Diese Proteine nehmen in verschiedenen Organismen Aufgaben wahr: Sauerstoffaktivierung, Sauerstofftransport, Redoxreaktionen und Hydrolysen. Ebenso wichtig ist dreiwertiges Eisen als Zentralion im Enzym Katalase, das in den Peroxisomen der Zellen das im Stoffwechsel entstehende Zellgift Wasserstoffperoxid abbaut.
Externer Elektronendonor und -akzeptor
Einige Bakterien nutzen Eisen(III) als Elektronenakzeptor für die Atmungskette. Sie reduzieren es damit zu Fe(II), was eine Mobilisierung von Eisen bedeutet, da die meisten Fe(III)-Verbindungen schwer wasserlöslich sind, die meisten Fe(II)-Verbindungen aber gut wasserlöslich. Einige phototrophe Bakterien nutzen Fe(II) als Elektronendonator für die Reduktion von CO2.[4]
Medizinische Bedeutung
Eisenbedarf und Eisenmangel
Vor allem Frauen vor den Wechseljahren leiden häufig an Eisenmangel, der Grund dafür ist die Menstruation. Sie sollten circa 15 Milligramm Eisen pro Tag zuführen, während der Tagesbedarf eines erwachsenen Mannes nur etwa 10 Milligramm beträgt. Außerdem verlieren Frauen zusätzlich bei der Geburt eines Kindes circa 1000 Milligramm Eisen. Durch die gleichzeitige Einnahme von Vitamin C wird die Resorptionsquote deutlich erhöht. Besonders reichhaltig ist Eisen in Fleisch, Leber, Hülsenfrüchten und Vollkornbrot enthalten. Gleichzeitiger Verzehr von Milchprodukten, Kaffee oder schwarzem Tee hemmen jedoch die Eisenaufnahme.
Toxizität und Eisenüberladung
Obwohl Eisen ein wichtiges Spurenelement für den Menschen ist, kann zu viel Eisen für den Körper toxisch, d. h. giftig sein. Zu große Mengen an Fe2+-Ionen reagieren mit Peroxiden, wobei freie Radikale entstehen. Im Normalzustand werden letztere durch körpereigene Prozesse kontrolliert.
Etwa ein Gramm Eisen verursacht bei einem zweijährigen Kind ernste Vergiftungserscheinungen, drei Gramm können bereits tödlich sein. Bei einem erwachsenen Mann treten ab ca. 2,5 Gramm Eisen (welches nicht in Hämoglobin gebunden ist) im Blut ernstzunehmende Vergiftungserscheinungen auf. Eine Regulationsstörung der Eisenaufnahme im Darm kann zur Hämochromatose, einer Eisenspeicherkrankheit, führen. Das Eisen reichert sich in der Leber an und führt dort zu Siderose (Ablagerung von Eisensalzen) und Organschäden. Daher sind Eisenpräparate nur bei Eisenmangel zu empfehlen. Allerdings nimmt ein gesunder Körper bei Eisenüberversorgung dieses nicht mehr aus der Nahrung auf.[5]
Eisen ist ein Übergangsmetall; es gibt Hinweise, dass ein Überangebot, vor allem von seiner zweiwertigen Form (Fe2+), im Gehirn unter bestimmter Voraussetzungen zu neurodegenerativen Erkrankungen wie z. B. der Parkinson- oder auch der Alzheimerkrankheit führen könnte. Jedoch ist noch nicht klar, ob die gefundenen Eisenablagerungen Ursache oder Folge der Erkrankung sind.[6]
Nachweis
Bei der Nachweisreaktion für Eisen-Ionen werden zunächst die beiden Kationen Fe2+ und Fe3+ unterschieden.
Eisennachweis mit Thioglykolsäure
Mit Thioglykolsäure lassen sich Fe2+- und Fe3+-Ionen nachweisen:
Bei Anwesenheit von Fe2+- oder Fe3+-Ionen entsteht eine intensive Rotfärbung.
Eisennachweis mit Hexacyanoferraten
Die Fe2+-Ionen lassen sich mit rotem Blutlaugensalz nachweisen:
Fe3+-Ionen lassen sich mit gelbem Blutlaugensalz nachweisen:
Bei beiden Nachweisreaktion entsteht tiefblaues Berliner Blau, ein wichtiger Farbstoff. Es läuft keine Komplexbildungsreaktion ab, sondern lediglich ein Kationenaustausch.
Beide Pigmente sind weitgehend identisch, da zwischen ihnen ein chemisches Gleichgewicht besteht. Dabei geht Fe3+ in Fe2+ über und umgekehrt:
Die besonders intensive blaue Farbe des Komplexes entsteht durch Metall-Metall-Charge-Transfers zwischen den Eisen-Ionen. Es ist bemerkenswert, dass dieses bekannte Eisennachweisreagenz selbst Eisen enthält, welches durch die Cyanidionen chemisch gut maskiert wird (Innerorbitalkomplex) und somit die Grenzen der chemischen Analytik aufzeigt.
Eisennachweis mit Thiocyanaten
Alternativ kann man Eisen(III)-salze mit Thiocyanaten (Rhodaniden) nachweisen. Diese reagieren mit Eisen(III)-Ionen zu Eisen(III)-thiocyanat:
Es bildet sich das tiefrote Fe(SCN)3, welches in Lösung bleibt. Allerdings stören einige Begleitionen diesen Nachweis (z. B. Co2+, Mo3+, Hg2+, Überschuss an Mineralsäuren), so dass u. U. ein Kationentrenngang durchgeführt werden muss.
Verbindungen
Wertigkeiten und Oxidationsstufen
- Fe2−, in [Fe(CO)4]2−, [Fe(CO)2(NO)2] hier ist das (NO)1+
- Fe1−, in [Fe2(CO)8]2−
- Fe0, als Fe(CO)5, Fe2(CO)9 sowie Fe3(CO)12
- Fe1+, äußerst ungewöhnlich, z. B. als [Fe(H2O)5NO]2+. (Ringprobe, Nachweis von NO3−)
- Fe2+, diese Salze sind zumeist blassgrün,
- Fe3+, diese Ionen sind fast farblos. Lösungen von Fe(III)-Salzen reagieren stark sauer und sind gelb gefärbt. Die Farbe entsteht durch Charge-transfer-Banden von Hydroxo-Ionen, wie bei [Fe(H2O)5OH]2+.
- Fe4+, kommt in Li2FeO3, BaFeO3 u. a. sowie in den Katalysezyklen einiger Enzyme vor (zum Beispiel Cytochrom-c-Oxidase, Cytochrom P450, Peroxidasen),
- Fe5+, FeO43−
- Fe6+, ist selten (beispielsweise K2FeO4, BaFeO4).
Oxide
Eisen bildet mit Sauerstoff zweiwertige und dreiwertige Oxide:
- Eisen(III)-oxid (Fe2O3) ist eine rote bis braune Substanz und entsteht durch Oxidation von Eisen im Sauerstoffüberschuss. In der Natur tritt es in Form der Minerale Hämatit und Maghemit auf.
- Eisen(II,III)-oxid (Fe3O4) entsteht auf natürlichem Wege durch vulkanische Vorgänge oder beim direkten Verbrennen von Eisen, z. B. mit dem Schneidbrenner als Eisenhammerschlag und wird als Mineral als Magnetit bezeichnet.
- Eisen(II)-oxid (FeO) entsteht nur bei der vorsichtigen Zersetzung von Eisen(II)-oxalat FeC2O4 im Vakuum. Es ist schwarz und bis 560 °C instabil. Als Mineral Wüstit entsteht es meist aus der Verwitterung von Magnetit.
Da diese Oxide keine feste Schutzschicht bilden, oxidiert ein der Atmosphäre ausgesetzter Eisenkörper vollständig. Wenn sie vor dem endgültigen Verrosten eingesammelt und dem Recycling zugeführt werden, sind verrostetes Eisen und verrosteter Stahl bei der Stahlproduktion im Elektro-Schmelzofen ein begehrter und wertvoller Sauerstoffträger. Dieser Sauerstoff im Eisenschrott wirkt beim „Stahlkochen“ als Oxidationsmittel, um ungewünschte qualitätsmindernde Beimengungen (z. B. Leichtmetalle) zu oxidieren (verbrennen).
Eisenoxide und Eisenhydroxide werden als Lebensmittelzusatzstoffe verwendet (E 172).
Salze
Eisen bildet zweiwertige und dreiwertige Salze:
- Eisen(II)-chlorid (FeCl2 · 6 H2O) wird angewendet zur Sulfidfällung, Faulgasentschwefelung, Biogasentschwefelung, Chromatreduzierung und Phosphatelimination; dazu gehört die Simultanfällung.
- Eisen(II)-sulfat (FeSO4 · 7 H2O) wird wegen seiner Farbe auch Grünsalz genannt, als Mineral Melanterit. Anwendungen wie beim Eisen(II)-chlorid, sowie bei getrocknetem Eisen(II)-sulfat als Chromatreduzierer speziell im Zement gegen die Chromatallergie.
- Eisen(III)-chlorid (FeCl3 · 6 H2O) kann Kupfer oxidieren und lösen; deshalb kann man wässrige Eisen(III)-chlorid-Lösungen zum schonenden Ätzen von Leiterplatten verwenden. Reaktionsformel:
- Eisen(III)-chloridsulfat (FeClSO4)
Alle Eisensalze werden unter anderem verwendet als Flockungsmittel und zur Phosphatelimination, dazu gehört die Vorfällung, Simultanfällung, Nachfällung und Flockenfiltration sowie Sulfidfällung, Faulgasentschwefelung, Biogasentschwefelung
Weitere Eisenverbindungen
Einzelne Eisenverbindungen:
- Fe3C, Eisencarbid,
- Fe(CO)5, Eisencarbonyl, Eisenpentacarbonyl, IPC (I für iron), entsteht unter Druck aus Eisen und Kohlenmonoxid und bildet nach seiner Zersetzung neben Kohlenmonoxid ein besonders reines Eisenpulver, das Carbonyleisen. Eine weitere Variante von Eisencarbonyl ist Fe2(CO)9 und Fe3(CO)12.
- Fe(SCN)3, Eisen(III)-thiocyanat, Eisenrhodanid, hat eine sehr ergiebige blutrote Färbung, dient zum Nachweis von Fe3+-Ionen.
Literatur
- BECK, Ludwig: Die Geschichte des Eisens in Technischer und kulturgeschichtlicher Beziehung, Braunschweig 1884ff.
- Harry H. Binder: Lexikon der chemischen Elemente - das Periodensystem in Fakten, Zahlen und Daten. Hirzel, Stuttgart 1999, ISBN 3-7776-0736-3
- Vagn Fabritius Buchwald: Iron and steel in ancient times. Kong. Danske Videnskab. Selskab, Kobenhagen 2005, ISBN 87-7304-308-7
- Otto Johannsen: Geschichte des Eisens, Düsseldorf 1925 (Digitalisat)
- H. Schoppa: Was der Hochöfner von seiner Arbeit wissen muß. Verlag Stahleisen., Düsseldorf 1992, ISBN 3-514-00443-9.
Siehe auch
- Eisen-Stoffwechsel – Bedeutung des Eisens im Organismus eines Lebewesens
- Elektrowerk (Weisweiler) – Herstellung von seltenen Legierungen wie Ferro-Chrom und Ferro-Molybdän
Weblinks
- Mineralienatlas:Eisen (Wiki), Mineralienatlas:Mineralienportrait/Eisen (Wiki)
- Eisengewinnung im Hochofen
- die-roemer-online.de Eisenherstellung in der Römerzeit
- Eisengewinnung in vorgeschichtlicher Zeit Landschaftsmuseum Obermain
- Nachhaltige Eisengewinnung früher, mit Lehmofen und Raseneisenerz Eisenherstellung vom WDR
Anmerkungen
- ↑ das Wort scheint Germanen und Kelten gemeinsam gewesen zu sein, die Abstammung von einer gemeinsamen indogermanischen Wurzel ist jedoch nicht sicher geklärt
Einzelnachweise
- ↑ Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag 1999, ISBN 3-7776-0736-3
- ↑ Sicherheitsdatenblatt(Carl Roth) Dies gilt nur für Pulver, kompaktes Eisen ist ohne Gefahrensymbole/R-/S-Sätze
- ↑ D. Glindemann, A. Dietrich, H.-J. Staerk und P. Kuschk Die zwei Gerüche des Eisens bei Berührung und unter Säureeinwirkung – (Haut)Carbonylverbindungen und Organophosphine, Angewandte Chemie 118 (2006) 7163–7166
- ↑ F. Widdel, S. Schnell, S. Heising, A. Ehrenreich, B. Assmus, B. Schink: Ferrous iron oxidation by anoxygenic phototrophic bacteria. In: Nature Vol. 362, 1993, S. 834–836.
- ↑ Nielsen P: [1]Einteilung der Eisenüberladung
- ↑ DEGUM: „DEGUM: Parkinson-Erkrankung vor dem Ausbruch erkennen“ Informationsdienst Wissenschaft, 6. Juli 2006
- ↑ Holleman, Wiberg: Lehrbuch der Anorganischen Chemie. (101. Auflage); Jander, Blasius: Lehrbuch der analytischen und präparativen anorganischen Chemie. (13. Auflage); Ehlers: Analytik I. (8. Auflage)
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga As Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Rn Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Uub Uut Uuq Uup Uuh Uus Uuo
Alkalimetalle Erdalkalimetalle Lanthanoide Actinoide Übergangsmetalle Metalle Halbmetalle Nichtmetalle Halogene Edelgase
Wikimedia Foundation.






![\mathrm{Fe^{2+} + 2 \ HS{-}CH_2{-}COOH \longrightarrow [Fe(SCH_2COO)_2]^{2-} + 4 \ H^+}](/pictures/dewiki/55/7d5307e584130b1205a8be2b74ac9efb.png)
_(III).JPG)
![\mathrm{3 \ Fe^{2+} + 2 \ K_3[Fe(CN)_6] \longrightarrow Fe_3[Fe(CN)_6]_2 + 6 \ K^+}](/pictures/dewiki/49/134fb019a3089e2c6efb03e1bd9221d8.png)
![\mathrm{4 \ Fe^{3+} + 3 \ K_4[Fe(CN)_6] \longrightarrow Fe_4[Fe(CN)_6]_3 + 12 \ K^+}](/pictures/dewiki/48/0b1a7296af3fc47b3113cc7046a68c0a.png)
![\mathrm{Fe^{2+} + [Fe(CN)_6]^{3-} \ \rightleftharpoons \ Fe^{3+} + [Fe(CN)_6]^{4-}}](/pictures/dewiki/100/d5990cc9a5d27f3351e6f29c5f1d2969.png)
-Ionen_und_Thiocyanat.JPG)