- Appel-Reaktion
-
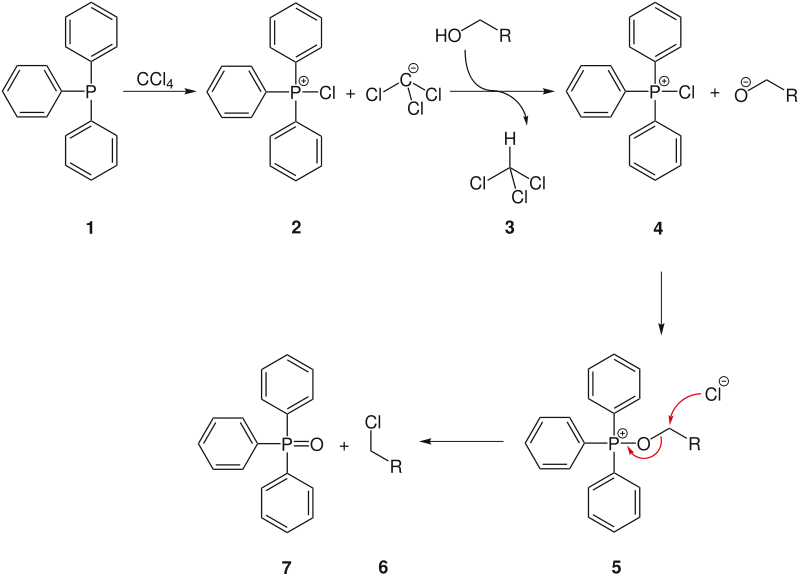
Die Appel-Reaktion ist eine nukleophile Subsitutionsreaktion vom Typ SN2, die in der organischen Chemie die Überführung von Alkoholen in die entsprechenden Alkylhalogenide ermöglicht. Bevorzugt werden dabei primäre und sekundäre Alkohole verwendet. Sie ist ein Spezialfall der Mukaiyama-Redoxkondensation. Die Reaktion ist nach ihrem Entdecker Rolf Appel (Universität Bonn) benannt, der seine Forschungsergebnisse dazu ab 1975 veröffentlichte.
Als Reagenzien werden stöchiometrische Mengen[1] von Triphenylphosphin (TPP = PPh3) und einem Tetrahalogenmethan, wie beispielsweise Tetrachlormethan (CCl4) oder Tetrabrommethan (CBr4) benötigt. Mit CF4 kann die Reaktion nicht durchgeführt werden.
Die treibende Kraft der Reaktion ist die Bildung der O=P-Doppelbindung, also die Oxidation von P-(III) zu P-(V). Nach Aktivierung des Triphenylphosphines erfolgt die Reaktion mit dem zwischenzeitlich gebildeten Alkoholat. Im zweiten Schritt wird Triphenylphosphinoxid als sehr gute Abgangsgruppe durch den nukleophilen Angriff des Bromid- oder Chlorid-Ions verdrängt und das gewünschte Produkt erhalten.[1]
Die Appel-Reaktion ist eine milde und moderne Variante zur Chlorierung oder Bromierung unter SN2-Bedingungen. Sie ist daher stereoselektiv unter Inversion der Konfiguration (Walden-Umkehr).[2]
Einzelnachweise
- ↑ a b Organische-Chemie.de: Appel-Reaktion, abgerufen am 4. Juli 2007
- ↑ EPF Lausanne: Substitutionsreaktionen an Aliphaten, abgerufen am 2. November 2011
Literatur
- Appel R, Tertiary Phosphane/Tetrachloromethane, a Versatile Reagent for Chlorination, Dehydration, and P–N Linkage., in Angew. Chem. Int. Ed. 1975, 14 (12), 801-811.
Wikimedia Foundation.