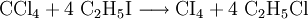- Tetraiodkohlenstoff
-
Strukturformel 
Allgemeines Name Tetraiodmethan Andere Namen Tetraiodkohlenstoff
Summenformel CI4 CAS-Nummer 507-25-5 Kurzbeschreibung roter Feststoff Eigenschaften Molare Masse 519,63 g·mol−1 Aggregatzustand fest
Dichte 4,32 g·cm−3 (20 °C)[1]
Schmelzpunkt 171 °C (Zersetzung)[1]
Löslichkeit - gut löslich in Ethanol und halogenierten Kohlenwasserstoffen
- unlöslich in Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung [2] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26-36 LD50 178 mg·kg−1 (Maus, i. v.) [2]
WGK 3 [2] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Tetraiodmethan, auch als Tetraiodkohlenstoff bezeichnet, ist eine chemische Verbindung aus der Reihe der Halogenkohlenwasserstoffe und stellt das vollständig iodierte Methan dar. Beide Bezeichnungen sind nach der IUPAC Nomenklatur korrekt, abhängig davon, ob man die Verbindung als organische (Tetraiodmethan) oder anorganische (Tetraiodkohlenstoff) Verbindung sieht.
Inhaltsverzeichnis
Eigenschaften, Synthese und Verwendung
Das kräftig rote Tetraiodmethan ist nach Fieser&Fieser[3] zusammen mit Iodoform die einzige farbige organische Verbindung, die keine ungesättigte Funktionen besitzt.
Der Gewichtsanteil an Kohlenstoff in CI4 beträgt lediglich 2 %. Die Bindungslänge Kohlenstoff–Iod beträgt in dem tetraedrisch aufgebauten Molekül 0,212 ± 0,002 nm.[4] Das Molekül ist mit Iod–Iod Abständen von 0,3459 ± 0,003 nm ausgesprochen dicht und eng gepackt. Sehr wahrscheinlich ist die Verbindung aus diesem Grund thermisch und photochemisch wenig stabil. Hexaiodethan ist, vermutlich aus dem gleichen Grund, als Molekül bisher unbekannt.
Tetraiodmethan kristallisiert im tetragonalen Kristallsystem in der Raumgruppe
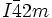 und den Gitterparametern a = 641 und c = 956 pm mit zwei Formeleinheiten pro Elementarzelle.[5] Durch den hochsymmetrischen, tetraedrischen Aufbau der einzelnen CI4-Moleküle besitzt die Verbindung kein Dipolmoment.
und den Gitterparametern a = 641 und c = 956 pm mit zwei Formeleinheiten pro Elementarzelle.[5] Durch den hochsymmetrischen, tetraedrischen Aufbau der einzelnen CI4-Moleküle besitzt die Verbindung kein Dipolmoment.CI4 ist in Wasser nahezu unlöslich, reagiert aber langsam mit Wasser unter der Bildung von Iodoform und Iod. In organischen unpolaren Lösungsmitteln ist es gut löslich. Thermisch und photochemisch zersetzt es sich zu Tetraiodethen (I2C=CI2).
Die Synthese von CI4 gelingt am besten über den Aluminiumchlorid-katalysierten Halogen-Austausch bei Raumtemperatur.[6]
Das Reaktionsprodukt kristallisiert dabei aus der Reaktionslösung aus. CI4 sollte kühl (2–8 °C) gelagert werden.
CI4 wird als Reagenz für Iodierungsreaktionen eingesetzt.[7] Alkohole können beispielsweise in einer Reaktion, die ähnlich der Appel-Reaktion verläuft, in Alkyliodide überführt werden.
Quellen
- ↑ a b Tetraiodmethan in: Roempp Chemie Lexikon, Thieme Verlag, 2008.
- ↑ a b c Tetraiodmethan bei sigma-aldrich
- ↑ FIESER/FIESER, Organische Chemie, 2. Aufl., S. 404–405 (Verlag Chemie, Weinheim 1979)
- ↑ Finbak C, Hassel O, Kristallstruktur und Molekülbau von CI4 und CBr4, inZeitschrift für Physikalische Chemie, B36/1937, S. 301–8
- ↑ S. Pohl:Die Kristallstruktur von CI4. In: Zeitschrift für Kristallographie, Nr. 159, 1982, S. 211–216.
- ↑ McArthur RE, Simons JH, Carbon Tetraiodide, in Inorganic Syntheses, Vol. III, 1950, S.37–39
- ↑ Schreiner PR, Fokin AA, Carbon Tetraiodide, in Encyclopedia of Reagents for Organic Synthesis, 2005, John Wiley & Sons, Ltd
Literatur
- Sorros H, Hinkam JB, The Redistribution Reaction. XI. Application to the Preparation of Carbon Tetraiodide and Related Halides, in JACS, 67/1945, S. 1643.
- Sato N, Ionization potentials of carbon tetraiodide and tetraiodoethylene in the solid state, in Chemical Physics, 113/1987, S. 445–51.
- Stammreich H et. al., The vibrational spectrum and force constants of carbon tetraiodide, in Spectrochimica Acta, 17/1961, S. 661–4.
- Sathianandan K, Substituted methanes Part XXXI. Molecular constants of carbon tetraiodide from vibrational spectra, in Journal of Molecular Spectroscopy, 8/1962, S. 470–4.
- Roldán-Arjona T, Mutagenic and lethal effects of halogenated methanes in the Ara test of Salmonella typhimurium: quantitative relationship with chemical reactivity., in Mutagenesis, 8/1993, S. 127–31.
- Anderson A, Raman and infrared spectra of some tetrahalide crystals., in Journal of Molecular Structure, 143/1986, S. 95–100.
- Carson AS et.al., The enthalpies of formation of iodomethane, diiodomethane, triiodomethane, and tetraiodomethane by rotating combustion calorimetry., in The Journal of Chemical Thermodynamics, 25/1993, S. 261–9.
Siehe auch
Wikimedia Foundation.