- Microfilament
-
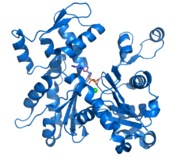
 F-Aktin; Darstellung von 13 Aktin-Untereinheiten (basierend auf dem Filamentmodell von Ken Holmes [1])
F-Aktin; Darstellung von 13 Aktin-Untereinheiten (basierend auf dem Filamentmodell von Ken Holmes [1])Aktin (engl. actin) ist ein Strukturprotein, das in allen eukaryotischen Zellen vorkommt. Es ist Bestandteil des Zytoskeletts und gleichzeitig eines der fünf häufigsten Proteine in Eukaryoten: In Muskelzellen ist jedes zehnte Proteinmolekül ein Aktinmolekül, in anderen Zellen beträgt der Anteil 1–5 %. In der Zelle bildet Aktin dynamische Filamente (die sogenannten Aktinfilamente). Diese Filamente dienen als Bestandteil des Zytoskeletts der Stabilisierung der äußeren Zellform, intrazellulären Transporten und sind zentraler Bestandteil des Kontraktionsapparats der Muskeln. Veränderungen in den für Aktine codierenden Genen können zu Muskel- und anderen Erkrankungen führen.
Inhaltsverzeichnis
Aufbau
Aktin wird von einer Genfamilie kodiert. Der Mensch hat sechs Isoformen, die sich nur in wenigen Aminosäuren unterscheiden.
Gen Protein Genlocus Länge (AA) OMIM Lokalisierung Pathologie ACTA1 alpha-1 1q42.13 375 [1] Skelettmuskulatur Nemalin-Myopathie Typ 3 (NM3); Kongenitale Myopathien (CM/CFTD) ACTA2 alpha-2 10q22-24 375 [2] Glatte Muskulatur; Aorta Familiäres thorakales Aortenaneurysma Typ 6 (AAT6) ACTB beta 7p15-p12 374 [3] Zytoplasma; Zytoskelett juvenile-onset dystonia ACTC1 kardial-alpha 15q11-14 375 [4] Herzmuskel Dilatative Kardiomyopathie Typ 1R (DCM1R); Hypertrophe Kardiomyopathie Typ 11 (HCM11) ACTG1 zytoplasmisch-2; gamma-1 17q25 374 [5] Zytoplasma; Zytoskelett non-syndromic sensorineural deafness autosomal dominant Typ 20 (DFNA20) ACTG2 gamma-2 2p13.1 374 [6] Glatte Muskulatur; Darm Liegt Aktin als einzelnes Molekül (monomer) vor, wird es als G-Aktin (globuläres Aktin) bezeichnet und ist ca. 42 kDa groß (375 Aminosäuren). Aktin ist mit nicht mehr als 15 % Unterschied von Algen bis hin zum Menschen eines der konserviertesten Proteine.
Polymerisation zu Aktinfilamenten
Der Polymerisationsvorgang, aber auch der Abbau des Filaments zu G-Aktin kann sehr dynamisch je nach den aktuellen Erfordernissen erfolgen.
G-Actin bindet das Nucleotid ATP Adenosintriphosphat. Dieses Monomer kann sich nun mit weiteren Aktinmolekülen verbinden - polymerisieren, wobei ATP unter Abspaltung (Hydrolyse) eines Phosphatrests zu ADP Adenosindiphosphat wird. Die entstehende Kette von Aktinmonomeren bildet so die filamentöse Form der Aktinfilamente, auch F-Aktin genannt. Das Filament besteht aus zwei Ketten polymerisierter G-Aktin-Monomere, die sich helixartig umeinanderwinden [1]. Der Durchmesser beträgt 7 nm. In der Zelle liegen beide Formen im Gleichgewicht vor, wobei Monomere hauptsächlich im Komplex mit Actin-bindenen Proteinen auftreten.
Jedes Aktinfilament besitzt ein (+)-Ende und ein (-)-Ende. ATP-Aktin bindet bevorzugt am (+)-Ende und das Filament wächst an diesem Ende. Das ATP wird in der Folge zu ADP hydrolysiert, wodurch die Bindungsstärke zu den benachbarten Aktinen nachlässt. Am (-)-Ende läuft die Hydrolyse von ATP zu ADP schneller als die Anlagerung eines neuen ATP-Aktins ab, sodass ADP-Aktin dissoziiert und das Filament von dieser Seite verkürzt wird. Aktinmonomere binden aber ATP stärker als ADP, tauschen damit das Nukleotid aus und können wieder am (+)-Ende eingefügt werden. Dieser schnelle Kreislauf ist für die Zellbewegungen wichtig [2].
Zahlreiche Begleitproteine steuern die Polymerisations- und Abbauvorgänge. Im Muskel werden die Filamente beispielsweise durch das Tropomyosin stabilisiert, das sich auf ganzer Länge an ein Filament anlegt.
Bestimmte Proteine bedecken auch die Enden und behindern oder fördern die Verlängerung oder den weiteren Abbau. Andere Proteine verhindern oder fördern die Polymerisation von G-Aktin oder bewirken den Zerfall des F-Aktin.
Beispielsweise setzen sich die Proteine Cofilin und ADF (Aktin depolymerisierender Faktor) an das (-)-Ende und fördern die Dissoziation von Aktin. Das Protein Profilin hingegen fördert den Einbau am (+)-Ende. Die Bindung von sowohl Cofilin als auch Profilin wird über das Aktingebundene Nukleotid bestimmt[3].
Auch posttranslationale Modifikationen von Aktin sind an der Polymerisierung beteiligt. So wird jedes fünfte Aktin-Monomer in Fibroblasten mit einer Arginylierung versehen, welches eine direkte Auswirkung auf die erhöhte Stabilität von Aktinfilamenten hat. Dabei wird vorrangig Beta-Aktin modifiziert [4].
Adapter- und Verbindungsproteine
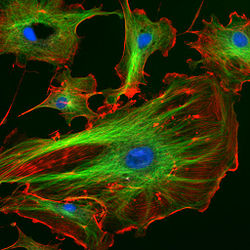
 Immunfluoreszenzfärbung des Aktin-Cytoskeletts (grün) und des fokalen Adhäsionsproteins Vinculin (rot) bei einer Fibroblasten-Zelle. Die Adhäsionsstellen sind als rote Flecken an den Enden der Aktin-Bündel erkennbar.
Immunfluoreszenzfärbung des Aktin-Cytoskeletts (grün) und des fokalen Adhäsionsproteins Vinculin (rot) bei einer Fibroblasten-Zelle. Die Adhäsionsstellen sind als rote Flecken an den Enden der Aktin-Bündel erkennbar.Eine große Gruppe von Begleitproteinen, die auch als Actin-bindende Proteine bezeichnet werden, vernetzt Aktinfilamente untereinander und mit anderen Proteinen. Fimbrin, Villin (Binnengerüst der Mikrovilli), Filamin und Espin bilden Querverbindungen und so mechanisch steife Bündel. α-Actinin bildet ebenfalls Bündel, die typischerweise mit Myosin (siehe unten) verspannt werden. Das Filamin wiederum bildet dreidimensionale Netze (Gele), wie man sie unter der Plasmamembran antrifft.
Actinfilamente strahlen in zwei Zellkontakte ein, die Adhärens-Kontakte und die Fokalkontakte. Dabei werden sie über Adaptorproteine an den Proteinstrukturen der Kontakte verankert. Verantwortlich dafür sind unter anderem wieder das α-Actinin, das Vinculin und Talin. Die Proteine der Familie um Ezrin, Radixin, Moesin (ERM-Proteine) vermitteln kurzzeitige und dynamische Bindungen an die Plasmamembran, zum Beispiel bei Änderung der Zellform und aktiver Zellbewegung.
Bestimmte Proteingruppen stellen eine mechanisch stabile Verbindung zwischen dem unter der Plasmamembran liegenden dichten Aktinnetz und der Membran her. Diese wegen verschiedener Erbkrankheiten auch klinisch recht bedeutsamen Proteine sind die Dystrophine (u. a. im Muskelgewebe, bei Mutationen im Dystrophin-Komplex Muskeldystrophien) und die Spectrine (u.a. verantwortlich für die Form der Erythrozyten, bei Defekt z. B. Kugelzellenanämie). Es handelt sich um lange, dünnere Proteine, die ihre Aufgaben in Komplexen mit zahlreichen anderen Proteinen erfüllen.
Die Proteinfamilie der Myosine stellt die Motorproteine des Aktins. Es sind mehr als 15 verschiedene Klassen mit jeweils mehreren Untertypen bekannt. Typischerweise besteht ein Myosinmeolekül aus einem Schwanz, der mit anderen Strukturen (zu transportierende Vesikel) oder einem anderen Myosinschwanz verbunden ist, und einem Köpfchen. Das Myosinköpfchen stellt eine ATPase dar, kann also ATP spalten und mit der gewonnenen Energie den Winkel des Köpfchens ändern. Da das Köpfchen an Aktinfilamente binden kann, bewegt sich das Molekül so am Filament entlang.
Funktion
Stabilität
Aktin bildet als Bestandteil des Zytoskeletts ein dichtes, steifes, dreidimensionales kortikales Netz unterhalb der Plasmamembran, das durch die oben genannten Verbindungsproteine vernetzt ist. An bestimmten, spezifischen Punkten der Zelle tritt dieses Netzwerk verstärkt auf, z.B. in Membranausbuchtungen (Mikrovilli, Pseudopodien, Synapsen) sowie bei bestimmten Zellkontakten (Adherens Junctions, Tight Junctions) und tragen so zur Form und Stabilität von Zellen und Geweben bei.
Verankerung und Transportstrecke
Viele Transmembranproteine (Kanäle, Pumpen, Rezeptoren, Zelladhäsionsproteine) werden direkt oder indirekt an diesem kortikalen Aktinnetzwerk „gefesselt“ an ihrem Platz gehalten. Funktionell zusammengehörende Proteine werden dadurch auch in räumlicher Nähe gehalten. Entlang des Aktinnetzes erfolgt auch der Kurzstreckentransport von Vesikeln zur Membran durch Myosine, eine Klasse von Motorproteinen (während der Langstreckentransport von Mikrotubuli mit deren Motorproteinen Dynein und Kinesin übernommen wird). Dabei übernehmen die Myosine zum Teil die von Dynein/Kinesin herangebrachten Ladungen.
Zellmotilität
Viele eukaryotische Zellen besitzen ein hohes Maß an Bewegungsfähigkeit, Zellmotilität oder auch Zellmigration genannt, um beispielsweise Eindringlinge in den Körper unschädlich machen zu können (Zellen des Immunsystems), Wunden heilen zu können (z.B. Hautzellen) oder um allgemein Zellen zu bewegen (in der Entwicklung oder bei einzelligen Organismen wie z.B. Amöben). Diese Beweglichkeit beruht hauptsächlich auf zwei Prozessen: Der gerichteten Aktinpolymerisierung in die Bewegungsrichtung (geregelt durch eine Anzahl von Regulatoren die auf Signale von der Zellperipherie reagieren), und der Aktin-Myosin-Interaktion in Fibrillenbündeln (stress fibers), kontraktile Zugseile, die durch die Zelle verlaufen und formgebende Elemente mit der Unterlage verspannen. Um die Zellumgebung zu "erfühlen" und eine neue Bewegungsrichtung einzuleiten, spielt die Ausbildung von Zellauswüchsen wie Filopodien und Lamellipodien eine bedeutende Rolle. Diese werden durch Aktinfilamente gebildet und stabilisiert.
Kontraktile Strukturen
Der Kontraktionsapparat aller Arten von Muskulatur, also alle makroskopische Bewegung des Körpers und seiner inneren Organe (z. B. Darmperistaltik), basiert auf der Aktin-Myosin-Wechselwirkung. Dabei sind zahlreiche Aktinfilamente, Myosin II und andere Proteine in großer Zahl in hochgeordneter Weise angeordnet. Für Details sei auf die Artikel zu Muskelgewebe verwiesen.
Quellen
- ↑ a b Holmes KC, Popp D, Gebhard W, Kabsch W.: Atomic model of the actin filament. Nature 1990, 347, 21-2 PMID 2395461
- ↑ Pollard T. D., Earnshaw W. D.: Cell Biology, First Edition, Saunders 2004, ISBN 1-4160-2388-7
- ↑ Didry D, Carlier MF, Pantaloni D: Synergy between actin depolymerizing factor/cofilin and profilin in increasing actin filament turnover. J Biol Chem. 1998; 273(40): 25602-11. PMID 9748225
- ↑ Karakozova M, Kozak M, Wong CC, Bailey AO, Yates JR 3rd, Mogilner A, Zebroski H, Kashina A: Arginylation of beta-actin regulates actin cytoskeleton and cell motility. Science 2006; 313(5784): 192-6. PMID 16794040
Wikimedia Foundation.