- Natrium-Kalium-Pumpe
-
Na+/K+-ATPase Bändermodell der Na+/K+-ATPase nach 3B8E Vorhandene Strukturdaten: 3B8E 1MO7 Masse/Länge Primärstruktur 1018+303+66 Aminosäuren Sekundär- bis Quartärstruktur α+β+γ, multipass Membranprotein Kofaktor Mg2+ Isoformen α1/2, β1/2, γ1/2 Bezeichner Gen-Name(n) ATP1A1, ATP1A2, ATP1A3, ATP1A4 Transporter-Klassifikation TCDB 3.A.3.1.1 Bezeichnung P-ATPase Enzymklassifikation EC, Kategorie 3.6.3.9 Hydrolase Reaktionsart Hydrolyse Substrat ATP + H2O + 3 Na+innen + 2 K+außen Produkte ADP + Phosphat + 3 Na+außen + 2 K+innen Vorkommen Übergeordnetes Taxon Lebewesen Die Natrium-Kalium-ATPase (genauer: 3 Na+/ 2 K+ - ATPase), auch als Natrium-Kalium-Ionenpumpe bezeichnet, ist ein in der Zellmembran verankertes Transmembranprotein. Das Enzym katalysiert unter Hydrolyse von ATP (ATPase) den Transport von Natrium-Ionen aus der Zelle und den Transport von Kalium-Ionen in die Zelle gegen den chemischen Konzentrationsgradienten und den elektrischen Ladungsgradienten und dient so seiner Aufrechterhaltung.
Der Proteinkomplex besteht aus zwei Polypeptiden, d.h. einer α-und einer β-Untereinheit, wobei das α-Element die funktionelle Einheit ist und das β-Element der Verankerung des Proteins in der Zellmembran dient. Die Natrium-Kalium-ATPase kommt in mehreren Isoformen der α-und β-Untereinheiten vor, mit Unterschieden in Verteilung, Affinität zu Herzglykosiden und Funktionen. Der α1-Isoenzymtyp findet sich in allen Zellen des Menschen, α2- und α3-Typen in den Nervenzellen und Herzmuskelzellen (Myokard). Seltene Mutationen in den ATP1A2- und ATP1A3-Genen können zu erblicher Migräne, alternierender Hemiplegie und Dystonie führen.[1][2][3]
Inhaltsverzeichnis
Geschichte
Die Na+/K+-ATPase wurde 1957 vom dänischen Mediziner Jens Christian Skou entdeckt.[4] 1997 erhielt Skou den Nobelpreis für Chemie „für die Entdeckung des ionentransportierenden Enzyms Natrium-Kalium-ATPase”.[5]
Funktion
Der gegenläufige Transport (Antiport) von 3 Na+ gegen 2 K+ über die Zellmembran erfolgt gegen die jeweiligen Konzentrationsgefälle und in der Summe gegen das elektrische Ruhemembranpotential (elektrogen); er ist damit gleich zweifach von extern zugeführter Energie abhängig: energieabhängiger / aktiver Transport. Jene wird in diesem Fall als chemische Bindungsenergie durch die Hydrolyse von ATP zur Verfügung gestellt.
Das Phänomen des ATP-getriebenen Transports ist für den Na+/K+ Transport durch die Plasmamembran am besten untersucht. Beide Kationen sind in Zellen ungleich verteilt:
- Die Na+-Konzentration im Inneren der Zelle ist gering (0,2–2 mmol/l);
- die K+-Konzentration im Inneren ist hoch (120–150 mmol/l).
Dieser lebenswichtige Konzentrationsgradient wird einerseits durch Kalium-Kanäle bewirkt (siehe Blutzucker-Sensorsystem), andererseits durch die elektrogene Natrium-Kalium-ATPase.
Mechanismus
ATP-Hydrolyse und Na+/K+-Transport sind strikt gekoppelt (elektrogenes Prinzip):
- Je Molekül ATP werden drei Na+-Ionen nach außen und zwei K+-Ionen nach innen befördert. In der Bilanz wird dem intrazellulären Raum also ein positiver Ladungsträger entzogen. Dieser Mechanismus ist die treibende Kraft für den Erhalt des, insbesondere für Nerven- und Muskelzellen funktional wichtigen elektrischen Ruhemembranpotentials. Es ist jedoch nicht die Ladungsbilanz der Pumpe allein, die zur Erzeugung des Ruhemembranpotentials führt. Die hohe Permeabilität der Zellmembran für K+-Ionen, die durch Kalium-Kanäle gegeben ist und die geringe Permeabilität für Na+-Ionen während des Ruhemembranpotentials sind ebenfalls für dessen Erhalt erforderlich.
- für den Pumpmechanismus sind Konformationsänderungen erforderlich, die durch Phosphorylierung eines Aspartat (Asp-) Restes der α-Untereinheit erzeugt werden.
- bei diesem Vorgang werden zunächst drei Na+-Ionen eingeschlossen;
- deren Abgabe nach außen erfolgt im Austausch gegen zwei K+-Ionen, deren Bindung eine Phosphatase aktiviert, die den Asp-Rest wieder dephosphoryliert.
Wirkung der Herzglykoside
- siehe auch Hauptartikel: Herzglykoside
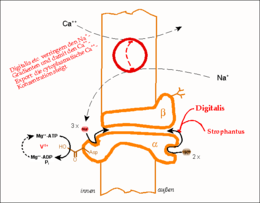 Das Wirkprinzip der Natrium-Kalium-Pumpe (Na+/K+-ATPase). Gezeigt ist eine Funktionseinheit, bestehend aus einer α- und einer β-Kette. Der Phosphorylierungs-Dephosphorylierungszyklus eines Aspartat-Restes, d.h. die treibende Kraft des Pumpvorganges, ist schematisch ausgeführt; dieser Vorgang kann durch Vanadat blockiert und damit nachgewiesen werden. Der im oberen Abschnitt gezeigte Calcium-Transporter (Na+/Ca2+-Antiporter) benutzt die Energie des ATP indirekt, indem er einen bestehenden Na+-Gradienten abbaut. Digitalis-Derivate blockieren die (Na+/K+-ATPase), lähmen damit die gesamte Wirkungskette und lassen den intrazellulären Ca2+-Spiegel ansteigen.
Das Wirkprinzip der Natrium-Kalium-Pumpe (Na+/K+-ATPase). Gezeigt ist eine Funktionseinheit, bestehend aus einer α- und einer β-Kette. Der Phosphorylierungs-Dephosphorylierungszyklus eines Aspartat-Restes, d.h. die treibende Kraft des Pumpvorganges, ist schematisch ausgeführt; dieser Vorgang kann durch Vanadat blockiert und damit nachgewiesen werden. Der im oberen Abschnitt gezeigte Calcium-Transporter (Na+/Ca2+-Antiporter) benutzt die Energie des ATP indirekt, indem er einen bestehenden Na+-Gradienten abbaut. Digitalis-Derivate blockieren die (Na+/K+-ATPase), lähmen damit die gesamte Wirkungskette und lassen den intrazellulären Ca2+-Spiegel ansteigen.
Glykoside der Digitalis-Gruppe (Digoxin, Digitoxin und dessen Aglykon Digitoxigenin) und der Gruppe der Strophanthusgewächse (g-Strophanthin (engl. Synonym: Ouabain) und k-Strophanthin) – letztere jedoch nur in hohen Konzentrationen – blockieren die K+-Konformation der ATPase noch im phosphorylierten Zustand. Damit hemmen sie den Ionentransport.
Indirekt steigt hierdurch die Konzentration an intrazellulärem Ca2+ und damit die Kontraktion des Herzmuskels, denn
- der Transport des Ca2+ hängt nach dem Antiport-Prinzip vom Na+-Konzentrationsgradienten ab (Natrium-Calcium-Austauscher).
- Ist dieser verringert, verbleibt Ca2+ in zunehmendem Maße in der Muskelzelle, wobei sich deren Kontraktion verstärkt.
Da die Herzmuskelzellen eines Menschen mit Herzinsuffizienz zu viel Calcium enthalten (calcium overload, der zur Minderung der Kontraktilität führt), war es bis vor kurzem unverständlich, wieso eine weitere Steigerung des zellulären Calcium-Gehalts zur Steigerung der Kontraktilität führen kann. Eine mögliche erklärende Hypothese: Die α2- und α3-Isoformen der Natrium-Kalium-Pumpen sind zusammen mit den Natrium-Calcium-Austauschern direkt über den Ausläufern des Calcium-Speichers der Zelle (Sarkoplasmatisches Retikulum) lokalisiert. Diese funktionelle Einheit wird Plasmerosom genannt. Hierdurch kann die lokale Natrium- bzw. Calcium-Konzentration durch Hemmung nur relativ weniger Natrium-Kalium-Pumpen durch Herzglykoside gesteigert werden, was das Sarkoplasmatische Retikulum zur Freisetzung von wesentlich größeren Mengen an Calcium an die kontraktilen Proteine (bei zum Beispiel jedem Herzschlag) anregt, ohne dass sich die Gesamt-Konzentration der Zelle an Natrium- und Calcium wesentlich verändert. Diese wird eher durch die α1-Isoform der Natrium-Kalium-Pumpe reguliert. Die Plasmerosome wurden für Nervenzellen und Arterien-Muskelzellen bereits nachgewiesen (Blaustein et al. 2002 und 1998) und sind wahrscheinlich auch in Skelett- und Herzmuskelzellen vorhanden.[6]
Geringe, das heißt physiologische Konzentrationen von g-Strophanthin, wie sie nach oraler Einnahme (auch nach niedrig dosierter intravenöser Injektion) oder endogen im Körper des Menschen gemessen werden (g-Strophanthin / Ouabain ist ein neuentdecktes Herzglykosid) führen zum Gegenteil des bisher einzig anerkannten Wirkmechanismus, das heißt zur Stimulation der Natrium-Kalium-Pumpe (ca. 50 Studien) mit resultierender Reduzierung des zellulären Natrium- und Calcium-Gehalts. Dies kann zu einem negativ inotropen Effekt wie bei einem Nitro-Präparat oder auch zu einem positiv inotropen Effekt führen (wahrscheinlich je nach Ausgangslage der Calcium-Konzentration der Herzmuskelzellen).[7][8][9]
Auch k-Strophanthin kann die Na-K-Pumpe stimulieren, jedoch nicht Digoxin (Saunders & Scheiner-Bobis 2004). Dies erklärt zum Beispiel die gegensätzliche Wirkung von Strophanthin und Digoxin bei Angina Pectoris, wobei Strophanthin positiv auf EKG und Anfallshäufigkeit wirkt, Digoxin bekanntlich jedoch negativ.[8][10]
Einzelnachweise
- ↑ Orphanet: Hemiplegische Migräne
- ↑ Orphanet: Alternierende Hemiplegie der Kindheit
- ↑ Orphanet: Dystonie-Parkinsonismus
- ↑ Skou, J.C. (1957): The influence of some cations on an adenosine triphosphatase from peripheral nerves. In: Biochim. Biophys. Acta. Bd. 23, S. 394–401. PMID 13412736
- ↑ Informationen der Nobelstiftung zur Preisverleihung 1997 an Jens Christian Skou (englisch)
- ↑ Blaustein MP, Juhaszova M, Golovina VA, Church PJ, Stanley EF: Na/Ca exchanger and PMCA localization in neurons and astrocytes: functional implications. In: Ann. N. Y. Acad. Sci.. 976, November 2002, S. 356–66. PMID 12502582.
- ↑ Gao J, Wymore RS, Wang Y, et al.: Isoform-specific stimulation of cardiac Na/K pumps by nanomolar concentrations of glycosides. In: J. Gen. Physiol.. 119, Nr. 4, April 2002, S. 297–312. PMID 11929882. Volltext bei PMC: 2238186.
- ↑ a b Saunders R, Scheiner-Bobis G: Ouabain stimulates endothelin release and expression in human endothelial cells without inhibiting the sodium pump. In: Eur. J. Biochem.. 271, Nr. 5, März 2004, S. 1054–62. PMID 15009217.
- ↑ Belz GG, Matthews J, Sauer U, Stern H, Schneider B: Pharmacodynamic effects of ouabain following single sublingual and intravenous doses in normal subjects. In: Eur. J. Clin. Pharmacol.. 26, Nr. 3, 1984, S. 287–92. PMID 6428911.
- ↑ Kubicek F, Reisner T: [Hypoxia tolerance in coronary heart disease as modified by digoxin, beta-methyl-digoxin and g-strophanthin]. In: Ther Ggw. 112, Nr. 5, Mai 1973, S. 747–9 passim. PMID 4708582.
Siehe auch
Weblinks
Kategorien:- Membran-ATPase
- Zellbiologie
- Neurophysiologie
- Krankheitsassoziiertes Protein
Wikimedia Foundation.