- Natriumformiat
-
Strukturformel 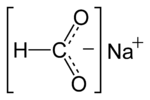
Allgemeines Name Natriumformiat Andere Namen Natriummethanoat
Summenformel CHNaO2 CAS-Nummer 141-53-7 Kurzbeschreibung farblose, zerfließliche, bitter-salzig schmeckende, rhombische Prismen oder Tafeln[1]
Eigenschaften Molare Masse 68,01 g·mol–1 Aggregatzustand fest
Dichte 1,92 g·cm–3 (20 °C) [2]
Schmelzpunkt Löslichkeit 550 g·l–1 (20 °C) in Wasser [2]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [2] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumformiat ist das Natriumsalz der Ameisensäure.
Inhaltsverzeichnis
Darstellung
Technisch wird Natriumformiat aus Natronlauge und Kohlenmonoxid bei 210 °C und unter sehr hohem Druck hergestellt:

- Natriumhydroxid reagiert mit Kohlenmonoxid zu Natriumformiat.
Eigenschaften
Physikalische Eigenschaften
Natriumformiat kristallisiert im monoklinen Kristallsystem in der Raumgruppe C21/n mit den Gitterparametern a = 6,19 Å, b = 6,72 Å, c = 6,49 Å und ß = 121,7°.[3]
Chemische Eigenschaften
Beim Erhitzen zersetzt sich Natriumformiat zunächst unter Bildung von Natriumoxalat und Wasserstoff.[4][5] Das entstandene Natriumoxalat geht beim weiteren Erhitzen unter Abgabe von Kohlenmonoxid in Natriumcarbonat über.[6][5]
Als Salz einer schwachen Säure (Ameisensäure) und einer starken Base (Natronlauge) reagiert eine Lösung von Natriumformiat in Wasser basisch:
Eine Lösung von Ameisensäure und Natriumformiat kann also als Pufferlösung eingesetzt werden.
Verwendung
Natriumformiat spielt bei der Synthese von Ameisensäure eine Rolle, hier wird es unter folgender Reaktionsgleichung mit Schwefelsäure zu dieser umgesetzt:

- Das Natriumformiat wird mit Schwefelsäure zu Ameisensäure und Natriumsulfat umgesetzt
Die Brennhaare der Brennnesseln enthalten neben Ameisensäure unter anderem auch Natriumformiat.
Natriumformiat ist schwach wassergefährdend und hemmt einige Bakterienarten, von anderen wird es jedoch abgebaut.
Natriumformiat wird auf Flughäfen als nichtkorrosives Streumittel eingesetzt. Das anfallende Schmelzwasser muss allerdings aufgefangen und gereinigt werden, bevor es in die Kanalisation gegeben werden kann.
Natriumformiat wird ebenfalls zur Herstellung von Oxalsäure verwendet.
Einzelnachweise
- ↑ Elisabeth Schwab, in: Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b c d Eintrag zu Natriumformiat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Juni 2008 (JavaScript erforderlich)
- ↑ W. H. Zachariasen: "The Crystal Structure of Sodium Formate, NaHCO2" in J. Am. Chem. Soc., 1940, 62(5), S. 1011–1013. doi:10.1021/ja01862a007
- ↑ MSDS bei J.T. Baker
- ↑ a b T. Meisel, Z. Halmos, K. Seybold, E. Pungor: "The thermal decomposition of alkali metal formates" in Journal of Thermal Analysis and Calorimetry 1975, 7(1). S. 73-80. doi:10.1007/BF01911627
- ↑ T. Yoshimori, Y. Asano, Y. Toriumi, T. Shiota: "Investigation on the drying and decomposition of sodium oxalate" in Talanta 1978, 25(10) S. 603-605. doi:10.1016/0039-9140(78)80158-1
Kategorien:- Formiat
- Natriumverbindung
Wikimedia Foundation.



