- Natriumsulfat
-
Strukturformel 
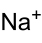
Allgemeines Name Natriumsulfat Andere Namen - Dinatriumsulfat
- E 514
- Glaubersalz (Decahydrat)
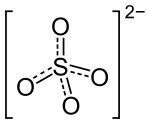
Summenformel Na2SO4 CAS-Nummer 7757-82-6 ATC-Code Kurzbeschreibung farb- und geruchloser Feststoff[1]
Eigenschaften Molare Masse 142,04 g·mol−1 Aggregatzustand fest
Dichte 2,70 g·cm–3 (20 °C)[1]
Schmelzpunkt Siedepunkt Zersetzung ab 890 °C[1]
Löslichkeit gut in Wasser: 170 g·l−1, bei 20 °C[1]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln EU-Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumsulfat (Na2SO4, veraltete Bezeichnung Schwefelsaures Natron) ist ein Natriumsalz der Schwefelsäure und setzt sich aus zwei Natriumkationen (Na+) und dem Sulfatanion (SO42-) zusammen. Das Dekahydrat (Na2SO4 · 10 H2O) wird nach dem Chemiker Johann Rudolph Glauber auch Glaubersalz genannt. Auch Karlsbader Salz, das durch Eindampfen von Karlsbader Mineralwasser gewonnen wird, besteht hauptsächlich aus Natriumsulfat-Dekahydrat und wird wie Glaubersalz als Abführmittel eingesetzt.
Inhaltsverzeichnis
Geschichte
Natriumsulfat wurde 1625 von dem Chemiker und Apotheker Johann Rudolph Glauber als Bestandteil von Mineralwasser entdeckt und beschrieben. Dabei beschrieb Glauber den salzigen Geschmack des Stoffes, dass es auf der Zunge schmilzt und im Gegensatz zu Salpeter nicht brennt, wenn man es in Feuer bringt. Zudem erkannte er, dass das erhaltene kristallwasserhaltige Natriumsulfat beim Erhitzen leichter wird. Auch die wichtigste medizinische Wirkung als Abführmittel erkannte Glauber schon zu dieser Zeit.[3]
Ab 1658 experimentierte Glauber mit Kochsalz und Schwefelsäure und erhielt dabei neben Salzsäure (als Spiritus salis, Geist des Salzes bezeichnet) auch Natriumsulfat, das er nun genauer untersuchen konnte. Dabei entdeckte er insgesamt 26 verschiedene mögliche medizinische Anwendungen, aber auch Anwendungen in der Alchemie und Kunst.[3]
Nach Johann Glauber wurde das Sal mirabilis später in der Regel Glaubersalz genannt.
Vorkommen
Natriumsulfat kommt in der Natur als orthorhombisch kristallisierender Thenardit (α-Na2[SO4]) bzw. als Hochtemperaturmodifikation (> 271° C) als trigonal kristallisierender Metathenardit sowie als wasserhaltiger Mirabilit (Na2[SO4] • 10H2O) vor.
Gewinnung und Darstellung
Natürlich vorkommendes Natriumsulfat wird auf Grund der Seltenheit nur selten bergmännisch abgebaut, fällt jedoch häufig als Nebenprodukt in der chemischen Industrie bei Reaktionen an, bei denen Schwefelsäure mit Natronlauge neutralisiert wird. Eine weitere Möglichkeit zur technischen Darstellung besteht in der Umsetzung von Steinsalz (NaCl) mit Schwefelsäure zwecks Gewinnung von Salzsäure mit Natriumsulfat als Nebenprodukt:

- Natriumchlorid und Schwefelsäure reagieren zu Natriumsulfat und Chlorwasserstoff.
Natriumsulfat lässt sich im Labor durch folgende Reaktionen darstellen:

- Natriumcarbonat und Schwefelsäure reagieren zu Natriumsulfat, Wasser und Kohlenstoffdioxid.

- Bei der Neutralisation von Natronlauge mit Schwefelsäure entstehen Natriumsulfat und Wasser.
Eigenschaften
Das wasserfreie Natriumsulfat schmilzt bei 888 °C, ist hygroskopisch und gut in Wasser unter Erwärmung (Lösungswärme) löslich. Dagegen löst sich das Dekahydrat unter starker Abkühlung, bedingt durch den sogenannten Entropie-Effekt. Das Kristallwasser verlässt ab etwa 32 °C den Kristallverband, wodurch es scheint, als schmelze das Natriumsulfat, tatsächlich löst es sich aber im frei gewordenen Wasser. Aus dieser an wasserfreiem Natriumsulfat übersättigten Lösung scheidet sich das wasserfreie Salz ab.
Verwendung
Natriumsulfat wird in Waschmitteln als Füllstoff, in der Medizin als Abführmittel, bei der Zellstoffgewinnung (Sulfatverfahren) sowie in der Glas-, Textil- und Farbindustrie eingesetzt. Geglühtes, kristallwasserfreies Natriumsulfat wird im Labor zur Trocknung von organischen Lösungsmitteln verwendet. Das Natriumsulfat-Dekahydrat (Glaubersalz) wird als Abführmittel und als Latentwärmespeichermaterial verwendet.
In der Lebensmitteltechnologie dient es als Festigungsmittel, Säureregulator und Trägersubstanz. Natriumsulfat und Natriumhydrogensulfat sind in der EU als Lebensmittelzusatzstoff der Nummer E 514 ohne Höchstmengenbeschränkung (quantum satis) für Lebensmittel allgemein zugelassen.[4]
Quellen
- ↑ a b c d e f Eintrag zu Natriumsulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25.4.2008 (JavaScript erforderlich)
- ↑ Natriumsulfat bei ChemIDplus.
- ↑ a b James C. Hill: Johann Glauber's discovery of sodium sulfate - Sal Mirabile Glauberi. In: Journal of Chemical Education. 56, 1979, S. 593, doi:10.1021/ed056p593.
- ↑ Natriumsulfate - Datenbank Zusatzstoffe

Bitte den Hinweis zu Gesundheitsthemen beachten!
Wikimedia Foundation.

