- P2O3
-
Strukturformel 
Allgemeines Name Phosphortrioxid Andere Namen - Diphosphortrioxid
- Tetraphosphorhexaoxid
Summenformel - P2O3
- P4O6
CAS-Nummer - 12440-00-5
- 1314-24-5
- 10248-58-5
PubChem 123290 Kurzbeschreibung wachsweicher farbloser Feststoff Eigenschaften Molare Masse 109,96 g·mol−1 bzw. 219,92 g·mol−1 Aggregatzustand fest
Dichte 2,134 g·cm−3[1]
Schmelzpunkt Siedepunkt 175,3 °C[1]
Löslichkeit gut in Benzol und Schwefelkohlenstoff[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Phosphortrioxid ist ein Oxid des Elementes Phosphor. Diese chemische Verbindung ist auch unter der Bezeichnung Diphosphortrioxid bekannt. Die im geschmolzenen, gelösten und dampfförmigen Zustand ermittelte Molekülmasse entspricht der Summenformel P4O6. Die wachsweichen, farblosen Kristalle sind sehr giftig.
Inhaltsverzeichnis
Darstellung
Phosphortrioxid entsteht bei der Verbrennung von weißem Phosphor bei niedrigen Temperaturen unter Sauerstoff-Mangel. Dabei beobachtet man eine starke Wärmeentwicklung:
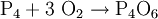
- Weißer Phosphor reagiert mit Sauerstoff zu Phosphortrioxid.
Eigenschaften
Physikalische Eigenschaften
Phosphortrioxid ist das Anhydrid der Phosphonsäure. Phosphor liegt in der Oxidationsstufe +3 vor. Die Kristalle dieser Verbindung besitzen eine Dichte von 2,14 g·cm−3. Der Schmelzpunkt liegt bei 24 °C, der Siedepunkt bei 175 °C unter einer Stickstoff-Atmosphäre. Phosphortrioxid löst sich in Benzol und Schwefelkohlenstoff.
Die Struktur des Phosphortrioxids leitet sich vom tetraedrischen Phosphormolekül P4 ab. Ersetzt man die sechs P–P-Bindungen - die Kanten des Tetraeders - jeweils durch P–O–P-Bindungen, so gelangt man zur oben dargestellten Molekülstruktur.
Die Struktur weist eine hohe Symmetrie auf. Neben der tetraedrischen Anordnung der Phosphor-Atome kann für die Sauerstoff-Atome eine oktaedrische Anordnung festgestellt werden. Die vier Flächen der tetraedrischen Grundstruktur werden von vier symmetrisch verknüpften P3O3-Sechsringen umrahmt. Diese Struktur findet man auch beim Arsenik (As4O6) sowie beim Urotropin (N4(CH2)6).
Chemische Eigenschaften
Phosphortrioxid oxidiert an der Luft weiter zu Phosphorpentoxid:
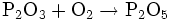
- Phosphortrioxid oxidiert zu Phosphorpentoxid.
Unter vermindertem Druck wird bei diesem Vorgang Chemilumineszenz beobachtet.
Oberhalb von 210 °C findet eine Zersetzung zu Phosphor und Phosphortetroxid statt:
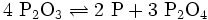
- Phosphortrioxid disproportioniert zu Phosphor und Phosphortetroxid.
In kaltem Wasser wird Phosphortrioxid zu Phosphonsäure umgewandelt:
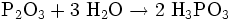
- Phosphortrioxid reagiert mit Wasser zu Phosphonsäure.
Die Reaktion mit Chlorwasserstoff führt zur Bildung von Phosphonsäure und Phosphortrichlorid:
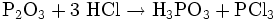
- Phosphortrioxid und Chlorwasserstoff reagieren zu Phosphonsäure und Phosphortrichlorid.
Mit den Halogenen Chlor und Brom reagiert Phosphortrioxid zu Phosphorylhalogeniden, mit Iod zu Diphosphortetraiodid.
Quellen
- ↑ a b c d Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, S. 786, ISBN 978-3-11-017770-1.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
Wikimedia Foundation.
