- Peroxyessigsäure
-
Strukturformel 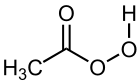
Allgemeines Name Peroxyessigsäure Andere Namen - Ethanperoxosäure
- Peressigsäure
Summenformel C2H4O3 CAS-Nummer 79-21-0 PubChem 6585 Kurzbeschreibung farblose, stechend riechende Flüssigkeit[1]
Eigenschaften Molare Masse 76,05 g·mol−1 Aggregatzustand flüssig
Dichte 1,226 g·cm−3 (25 °C)[1]
Schmelzpunkt Siedepunkt 105 °C[2]
Dampfdruck Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [4] 



Gefahr
H- und P-Sätze H: 226-242-332-312-302-314-400 EUH: keine EUH-Sätze P: 261-273-280-305+351+338-310 [5] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [4] 


Ätzend Brand-
förderndUmwelt-
gefährlich(C) (O) (N) R- und S-Sätze R: 7-10-20/21/22-35-50 S: (1/2)-3/7-14-36/37/39-45-61 MAK nicht eingestuft, da Verdacht auf krebserezeugende Wirkung[1]
LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Die Peroxyessigsäure (Abk.: PES) ist eine farblose, stechend riechende Flüssigkeit, die sich chemisch von der Essigsäure ableitet und zu den Peroxycarbonsäuren (und damit zu den Peroxiden) gehört. In höheren Konzentrationen kann sich Peroxyessigsäure explosiv zersetzen.
Inhaltsverzeichnis
Geschichte
Peroxyessigsäure war schon bekannt, kurz nachdem Wasserstoffperoxid im Labor hergestellt werden konnte. Aufgrund ihrer Sensibilität gegenüber Metallspuren lernte man jedoch erst um 1930, sie industriell einzusetzen. Dennoch passierten viele Unfälle und sie konnte sich nicht durchsetzen, bis ab 1960 Kunststoffgefäße für Transport und Lagerung zur Verfügung standen. Danach entdeckte man in den einzelnen Ländern unterschiedliche Anwendungen, die größere Produktionsmengen rechtfertigten.
- In der DDR wurde sie aus politischen Erwägungen gefördert, um gegen einen bakteriologischen Angriff aus dem Westen gerüstet zu sein. Solange der nicht kam, musste die täglich produzierte Menge jedoch verkauft werden. Man fand die Tierstalldesinfektion als ideales Anwendungsgebiet für große Mengen.
- In England sträubten sich viele Kommunen, die in der Nähe des Meeres lagen, gegen den Bau einer Kläranlage. So desinfizierte man die Abwässer mit PES und pumpte die Fäkalien dann einfach ins Meer. Eine weitere sehr britische Anwendung rührte aus der unbefriedigenden Lagerfähigkeit der Sandwiches her, die Sandwiches waren oft schon nach Stunden durch die Mayonnaise durchgeweicht. Dem half man ab, indem man das Sandwichmehl mit natürlichen Fasern aus der Zuckerrübe vermischte. Allerdings waren diese Fasern grau und störten das Weiß der Sandwichscheiben. Deshalb wurden die Fasern mit PES gebleicht.
- In Österreich ersetzte man in Zuckerfabriken mit PES das bis dahin zur Desinfektion der Auslauganlage eingesetzte Formalin.
- In Italien hatte man zwar moderne Kläranlagen, aber die konnten aufgrund der hohen Temperaturen nicht die Abwassernormen erfüllen. So wurden die geklärten Abwässer noch mit PES nachdesinfiziert.
Gewinnung und Darstellung
Peroxyessigsäure wird durch Mischen von Essigsäure mit Wasserstoffperoxid hergestellt. Dabei bildet sich eine Gleichgewichtsmischung von Peroxyessigsäure, Essigsäure, Wasserstoffperoxid und Wasser.
Die Gleichgewichtseinstellung wird durch starke Säuren (Schwefelsäure) beschleunigt. Da das Verdünnen einer Peroxyessigsäurelösung automatisch zur Einstellung eines neuen Gleichgewichtes mit niedrigerem Peroxyessigsäuregehalt führt, ist die Lagerung verdünnter Reste nicht sinnvoll.
Kommerziell erhältlich ist Gleichgewichtsperoxyessigsäure in Konzentrationen zwischen 2,5% und 40%. Eine Alternative ist die Vakuumdestillation der Peroxyessigsäure aus einer Gleichgewichtsmischung. Wegen der Nähe der Siedepunkte erhält man dabei 38% bis 40% Peroxyessigsäure zusammen mit Wasser. Diese Mischung ist nicht stabil und muss zur Lagerung und zum Transport auf 0 °C gekühlt bleiben. Sie wird zur TCF-(Total-Chlor-Freien) Bleiche von Sulfatzellstoff verwendet.
Technisch kann PES durch Oxidation von Acetaldehyd hergestellt werden.
Eigenschaften
Beim Erhitzen zerfällt die Peroxyessigsäure explosionsartig. Die Verbindung wirkt aufgrund ihrer funktionellen Gruppe stark oxidierend. PES ist unpolarer als Wasserstoffperoxid und demzufolge etwas fettlöslicher (lipophil). Peroxyessigsäure ist eine schwächere Säure als Essigsäure, ihre Salze können isoliert werden.
Die Dampfdruckfunktion ergibt sich nach August entsprechend lg(P) = −A/T+B (P in Torr, T in K) mit A = 2311 und B = 8,911 im Temperaturbereich von 0 °C bis 110 °C.[3]
Peressigsäure bildet in Lösung in Essigsäure oder Ethylacetat detonationsfähige Gemische. Diese Eigenschaft ist konzentrations- und temperaturabhängig.[6]
Detonationsfähigkeit von Peressigsäure in Essigsäure.[6] Konzentration in Ma% 20 30 40 45 50 54 57 Temperatur in °C 112 97 81 70 58 40 20 Verwendung
Die stark oxidierende Wirkung bedingt den Einsatz als Bleichmittel, unter anderem bei Papieren, Textilien und Stärke und als Desinfektionsmittel (in ca. einprozentiger Konzentration) und Sterilisationsmittel (z.B. bei der kaltaseptischen Abfüllung von Getränken in Kunststoffflaschen aus PET oder HDPE). Als chemisches Oxidationsmittel wird die Peroxyessigsäure auch zur Epoxidierung von Alkenen eingesetzt.
Sicherheitshinweise
Bei Mensch und Tier wirkt die Peroxyessigsäure stark haut- und augenreizend.
PES zersetzt sich selbstbeschleunigend und ist besonders gegen äußere Erhitzung und Verunreinigung empfindlich. Die exotherme Zersetzung führt zur Erhitzung der Flüssigkeit, die bis zum Aufkochen und Verpuffen führen kann. Die Gefahr nimmt mit der Konzentration und der Gebindegröße stark zu. Die Konzentration technisch eingesetzter Lösungen wird deshalb üblicherweise auf unter 15 % beschränkt.
Einzelnachweise
- ↑ a b c d e f g Eintrag zu CAS-Nr. 79-21-0 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25.08.2011 (JavaScript erforderlich)
- ↑ a b Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ a b Egerton, A.C.; Emte, W.; Minkoff, G.J.: Some properties of organic peroxides in Discuss. Faraday Soc. 10 (1951) 278–282, doi:10.1039/DF9511000278.
- ↑ a b Eintrag zu CAS-Nr. 79-21-0 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Datenblatt Peracetic acid solution bei Sigma-Aldrich, abgerufen am 18. April 2011.
- ↑ a b Phillips, B; Starcher, P.S.; Ash, B.D.: Preparation of Aliphatic Peroxyacids in J. Org. Chem. 23 (1958) 1823–1826, doi:10.1021/jo01106a001.
Weblinks
- Richtiger Umgang mit Peressigsäure (PDF-Datei; 1,04 MB)
Kategorien:- Gesundheitsschädlicher Stoff
- Ätzender Stoff
- Brandfördernder Stoff
- Umweltgefährlicher Stoff
- Peroxycarbonsäure
Wikimedia Foundation.

