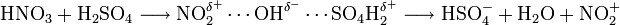- 1-Methyl-2,4,6-Trinitrobenzen
-
Strukturformel 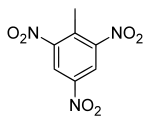
Allgemeines Name Trinitrotoluol Andere Namen - 2-Methyl-1,3,5-trinitrobenzol
- 1-Methyl-2,4,6-trinitrobenzol
- 2-Methyl-1,3,5-trinitrotoluen
- 1-Methyl-2,4,6-trinitrotoluen
- TNT
- Trotyl
- AN
- Tol
- Tolit
- Tritol
- Trisol
- Tutol
Summenformel C7H5N3O6 CAS-Nummer 118-96-7 PubChem 8376 Kurzbeschreibung hellgelbe, nadelförmige Kristalle Eigenschaften Molare Masse 227,13 g·mol−1 Aggregatzustand fest
Dichte Schmelzpunkt 80,35 °C [1]
Siedepunkt Zersetzung ab 160 °C [1]
Dampfdruck 0,057 Pa (81 °C)
Löslichkeit sehr schlecht in Wasser (140 mg/l, 20 °C) [1], gut in Ether, Aceton, Benzen, Pyridin
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 


Explosions-
gefährlichGiftig Umwelt-
gefährlich(E) (T) (N) R- und S-Sätze R: 2-23/24/25-33-51/53 S: (1/2)-35-45-61 MAK keine Einstufung, da im Tierversuch krebserzeugend [1]
WGK 2 [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Trinitrotoluol (TNT), nach IUPAC-Nomenklatur 2-Methyl-1,3,5-trinitrobenzol ist ein Sprengstoff. Hergestellt wurde TNT erstmals von Joseph Wilbrand im Jahre 1863, die Großproduktion wurde in Deutschland 1891 aufgenommen.
Die Sprengkraft von TNT wird zum Maßstab der Stärke von Bomben und anderen Sprengkörpern verwendet (siehe TNT-Äquivalent).
Inhaltsverzeichnis
Geschichte
TNT wurde zum ersten Mal 1863 von Joseph Wilbrand in unreiner Form synthetisiert. Mit der Entwicklung der reinen Synthese 1880 durch P. Hepp und der Entdeckung von TNT als geeignetem Explosivstoff durch Häussermann 1889 kam es in Deutschland ab 1901 zur großtechnischen Produktion. Besonders durch den Bedarf des Militärs an TNT als Füllung von Granaten (ab 1902 zuerst in Deutschland) entstanden rasch zahlreiche Fabriken. Der Ausgangsstoff für die Herstellung von Trinitrotoluol, Toluol, konnte damals aber nur in begrenzter Menge hergestellt werden, da man auf die Gewinnung aus Steinkohlenteer angewiesen war, einem Gemisch aus Tausenden von Einzelsubstanzen, welches bei der Koksgewinnung anfällt. Aus heutiger Sicht ist diese Methode allerdings nicht mehr wirtschaftlich, da der Anteil des Toluols im Steinkohlenteer relativ gering ist.
Im Zweiten Weltkrieg wurde TNT wiederum verstärkt produziert. Sogenannte „Schlaffabriken“ wurden schon vor Kriegsanfang errichtet, zumeist mit zweifacher Ausführung der Anlagen, damit bei Zerstörungen und Beschädigungen weiter Sprengstoff hergestellt werden konnte. Die produzierten Mengen hatten drastisch zugenommen. So belief sich die Menge des im Deutschen Reich produzierten TNT auf 18.000 Tonnen pro Monat, während des Krieges wurden insgesamt ca. 800.000 Tonnen hergestellt. Diese Steigerung war möglich, weil das notwendige Edukt nun auch aus Erdöl gewonnen werden konnte. In einem zweistufigen Prozess, dem „Deutschen Verfahren“, wurde das Toluol zunächst einfach nitriert. Das entstandene Mononitrotoluol (MNT) reinigte man von unerwünschten Nebenprodukten und nitrierte erneut, wodurch über Dinitrotoluol (DNT) das gewünschte Roh-TNT erzeugt wurde. Nach mehrfachem Waschen und Trocknen konnte es granuliert und dann verarbeitet werden. Sicherheitsmaßnahmen wurden dabei vernachlässigt, um für Nachschub an der Front zu sorgen. Da TNT lange Zeit für ungiftig gehalten wurde, neutralisierte man lediglich die Abfälle und ließ sie in Naturgewässer fließen, wo sie sich teilweise in Form von Schlamm ablagerten und als Rüstungsaltlasten die Umwelt schädigen. Hinsichtlich der unbekannten Toxizität ist bekannt, dass zwischen 1911 und 1915 279 Munitionsarbeiter gestorben sind, weil sie kleine Mengen über Haut und Atemwege aufgenommen hatten.
Gewinnung und Darstellung
Für die Herstellung von TNT kann Toluol mit Nitriersäure, einer Mischung aus Schwefel- und Salpetersäure nitriert werden. Erstere protoniert aufgrund ihrer größeren Säurestärke die Salpetersäure. Es werden dadurch wesentlich mehr reaktive elektrophile NO2+-Ionen (auch Nitryl-Kation oder Nitroniumion) gebildet. Die NO2+-Ionen sind die reaktiven Moleküle im Reaktionsgemisch, durch die die elektrophile Substitution am Aromaten ermöglicht wird.
Die Bildung des Trinitrotoluols erfolgt in Stufen. Zunächst erfolgt die Mononitrierung des Toluols, die auf Grund des induktiven Effekt der Methylgruppe mit 96 %iger Wahrscheinlichkeit in ortho- oder para-Position stattfindet. Das nun gebildete Nitrotoluol kann vom starken Elektophil NO2+ weiter nitriert werden, bis mit drei die maximale Anzahl an Nitrogruppen im Molekül vorhanden ist und damit Trinitrotoluol entstanden ist.
Eigenschaften
Physikalische Eigenschaften
Trinitrotoluol kann in zwei polymorphen Formen auftreten, die sich schon anhand ihrer Farbe unterscheiden lassen.[4][5] Die stabile, monokline Form bildet hellgelbe, nadelförmige Kristalle, die bei 80,4 °C schmelzen.[4][5] Eine metastabile, orthorhombische Form bildet orange Kristalle. Beim Erhitzen auf 70 °C erfolgt eine Umwandlung zur monoklinen Form.[4][5] In Wasser ist die Verbindung sehr schwer löslich, mäßig löslich in Methanol (1 Ma%[4]) und Ethanol (3 %[4]), gut löslich hingegen in Ether, Ethylacetat (47 %[4]), Aceton, Benzol, Toluol (55 Ma%[4]) und Pyridin. Mit seinem niedrigen Schmelzpunkt von 80,8 °C lässt sich TNT in Wasserdampf schmelzen und kann in Formen gegossen werden. Die Verbindung kann im Vakuum destilliert werden. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 5,37280, B = 3209,208 und C = −24,437 im Temperaturbereich von 503 K bis 523 K.[6] Die Verbindung verträgt eine Dauererhitzung bis 140 °C. Oberhalb von 160 °C setzt eine Gasentwicklung ein. Ab 240 °C tritt eine Verpuffung unter starker Rußentwicklung auf.[1] TNT ist giftig und kann bei Hautkontakt allergische Reaktionen hervorrufen. Es färbt die Haut leuchtend gelborange.
Explosivität
TNT ist einer der bekanntesten chemisch homogenen, also nur aus einer Komponente bestehenden, Explosivstoffe. Er verdankt seine Explosivität, wie alle homogenen Explosivstoffe, seiner chemischen Instabilität und der Bildung wesentlich stabilerer, gasförmiger Produkte. Der für die Explosion nötige Brennstoff und der Oxidator sind dabei im Molekül der Substanz gebunden.
Wird dem TNT-Molekül durch ein geeignetes Verfahren (Druck- und Wärmeeinwirkung) Energie zugeführt, wird die exotherme Reaktion zu den energieärmeren Produkten wie z. B. Stickstoff, Kohlenstoffdioxid, Methan, Kohlenmonoxid oder Cyanwasserstoff ermöglicht. Die letzteren entstehen wegen des zu geringen Sauerstoffanteils im Molekül. Wurde eine ausreichende Menge der Substanz gezündet, erhält die abgegebene Energie die Reaktion aufrecht und die gesamte Stoffmenge reagiert. Die Umsetzung erfolgt dabei in einer sehr schnellen, schmalen Reaktionszone, welche die Substanz wie eine Welle durchläuft. Die Geschwindigkeit dieser Reaktionszone erreicht bei leistungsfähigen Explosivstoffen mehrere tausend Meter pro Sekunde, überschreitet also die innerstoffliche Schallgeschwindigkeit. Durch die freigesetzte Energie und die Entstehung von Gasen als Reaktionsprodukte kommt es zu einem extrem steilen Druck- und Temperaturanstieg, was die Effizienz brisanter Sprengstoffe begründet.
Wichtige sicherheitstechnische Kenngrößen zum Explosionsverhalten sind:[2]
- Detonationsgeschwindigkeit: 6900 m/s (Dichte: 1,6 g/cm³)
- Bleiblockausbauchung: 300 ml/10 g
- Schlagempfindlichkeit: 15 Nm (1,5 kpm)
- Reibempfindlichkeit: bis 353 N (36 kp) keine Reaktion
- Grenzdurchmesser beim Stahlhülsentest: 5 mm
- Explosionswärme: 3725 kJ/kg
Verwendung
TNT ist noch heute der wichtigste militärische Sprengstoff und hat eine Detonationsgeschwindigkeit von 6900 m/s. Verwendung findet er sowohl im militärischen als auch im gewerblichen Bereich in Mischungen als Sicherheitssprengstoff, der nur durch Initialzündung (beispielsweise mittels Sprengkapsel) zum Detonieren gebracht werden kann. Gegossenes TNT benötigt zur sicheren Zündung sogar eine Verstärkerladung, einen sog. Booster. TNT allein kann durch Feuer oder Hitze nicht zur Explosion gebracht werden; es brennt einfach ab. Aufgrund der hohen Herstellungskosten (etwa das 20fache gewerblicher Sprengstoffe) ist sein Haupteinsatzgebiet jedoch vornehmlich der militärische Bereich, in dem es als Gefechtsladung von beispielsweise Granaten, Bomben und Minen zum Einsatz kommt.
Der Energiegehalt beträgt in SI-Einheiten:
- 1 kg TNT = 4,6 Megajoule (4,6 · 106 Joule)
Die häufig im Zusammenhang mit atomaren Explosionen verwendete Einheit TNT-Äquivalent basiert hingegen auf der Kalorie und ist definiert durch
- 1 KT (Kilotonne TNT) = 1012 cal = 4.184 · 1012 J.
Die Einheiten Megatonne und Gigatonne sind analog definiert. Durch die Großschreibung soll die Verwechslung mit der Masseneinheit Kilotonne verhindert werden.
Chemisch verwandte Sprengstoffe
Einzelnachweise
- ↑ a b c d e f g Eintrag zu CAS-Nr. 118-96-7 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 2. Februar 2009 (JavaScript erforderlich).
- ↑ a b J. Köhler, R. Meyer, A. Homburg: Explosivstoffe, Zehnte, vollständig überarbeitete Auflage, Wiley-VCH Verlag GmbH & Co. KGaA Weinheim 2008, ISBN 978-3-527-32009-7.
- ↑ Eintrag zu CAS-Nr. 118-96-7 im European chemical Substances Information System ESIS
- ↑ a b c d e f g H. G. Gallagher, J. N. Sherwood: "Polymorphism, twinning and morphology of crystals of 2,4,6-trinitrotoluene grown from solution", in: J. Chem. Soc., Faraday Trans. 1996, 92, 2107–2116; doi:10.1039/FT9969202107.
- ↑ a b c Ranko M. Vrcelj, John N. Sherwood, Alan R. Kennedy, Hugh G. Gallagher, Thomas Gelbrich: "Polymorphism in 2-4-6 Trinitrotoluene", in: Crystal Growth & Design 2003, 3 (6), 1027–1032; doi:10.1021/cg0340704.
- ↑ Yu Maksimov: "Steam Pressures of Nitroaromatic Compounds at Different Temperatures", in: Zh. Fiz. Khim. 1968, 42, 2921–2925.
Literatur
- Richard Escales: Nitrosprengstoffe. Survival Press, 1915 Reprint 2003, ISBN 3-8330-0114-3
- Wolfgang Asselborn, u. a.: Chemie heute. Sekundarbereich II. Schülerband Schroedel Verlag, Hannover 1999, ISBN 3-507-10618-3
- Hans-Jürgen Quadbeck-Seeger, u. a.: Chemie Rekorde. Menschen, Märkte, Moleküle. 2. Auflage, Wiley-VCH, 1999, ISBN 3-527-29870-3
- Dr. H.-D. Barke, K. Dehnert, M. Jäckel, Dr. J. Jaenicke, G. Krug, H. Oehr, E. Petrak, W. Rauh, U. Rehbein, Dr. K. Risch: Chemie heute. Sekundarbereich I. Schroedel Verlag, Hannover 1988
- M. E. Walsh, T. F. Jenkins, P. S. Schnitker, J. W. Elwell, M. H. Stutz: Evaluation of SW846 Method 8330 for characterization of sites contaminated with residues of high explosives, CRREL Report 93-5, U.S.Army Cold Regions Research and Engineering Laboratory, Hanover, NH
Weblinks
Wikimedia Foundation.