- Salpetrigsaures Kalium
-
Strukturformel 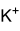
Allgemeines Name Kaliumnitrit Andere Namen Salpetrigsaures Kalium, E 249
Summenformel KNO2 CAS-Nummer 7758-09-0 Kurzbeschreibung weißlich-gelber Feststoff Eigenschaften Molare Masse 85,10 g·mol–1 Aggregatzustand fest
Dichte 1,92 g·cm–3[1]
Schmelzpunkt Siedepunkt Zersetzung[1]
Löslichkeit gut in Wasser (2810 g/L bei 20 °C)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 


Brand-
förderndGiftig Umwelt-
gefährlich(O) (T) (N) R- und S-Sätze R: 8-25-50 S: (1/2)-45-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kaliumnitrit, KNO2 (auch: Salpetrigsaures Kalium, englisch: potassium nitrite), ist das Kaliumsalz der Salpetrigen Säure HNO2.
Inhaltsverzeichnis
Eigenschaften
Kaliumnitrit bildet farblose bis leicht gelbliche, stark hygroskopische (= feuchtigkeitsanziehende) Kristalle, die sich gut in Wasser unter Abkühlung lösen, die Lösung reagiert alkalisch. Die Kristalle zersetzen sich ab 360 °C. Sonst verhält es sich ähnlich wie Natriumnitrit, das heißt es ist brandfördernd (vor allem bei höheren Temperaturen) und reagiert heftig mit Metallen wie Aluminium (vor allem in Pulverform!), trockenen Ammoniumverbindungen (wie beispielsweise Ammoniumsulfat), Cyaniden und vielen organischen Verbindungen. Es ist ein Reduktionsmittel und wird an der Luft langsam zu Kaliumnitrat KNO3 oxidiert.
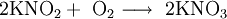
Kaliumnitrit ist giftig; im allgemeinen können Nitrite mit bestimmten Aminen bei geeigneten Bedingungen zu krebserregenden Nitrosaminen reagieren. Nitrit kann mit Eisen(II)-sulfat und konzentrierter Schwefelsäure durch Braunfärbung nachgewiesen werden.
Vorkommen und Herstellung
In der Natur kommen Nitrite als Zwischenstufen im Stickstoffkreislauf vor – sowohl bei der Nitrifikation (Stickstoffbindung) als auch bei der Denitrifikation (Stickstoff-Freisetzung). Technisch gewinnt man Kaliumnitrit durch Einwirkung von Stickoxiden auf Kaliumhydroxidlösung.
Verwendung
Kaliumnitrit darf als Lebensmittelzusatzstoff der Nummer E 249 (Konservierungsmittel) unter bestimmten Auflagen im Nitritpökelsalz (Natriumchlorid mit Kaliumnitrit und Natriumnitrit) eingesetzt werden. Es verleiht dem Fleisch durch Bildung von Nitrosomyoglobin eine bleibende rote Farbe. Fleisch- und Wursterzeugnisse dürfen ein Vielfaches des Trinkwassergrenzwertes von Nitrit enthalten.
Quellen
- ↑ a b c d Eintrag zu CAS-Nr. 7758-09-0 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 14. Dez 2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 7758-09-0 im European chemical Substances Information System ESIS
Wikimedia Foundation.
