- Taxifolin
-
Strukturformel 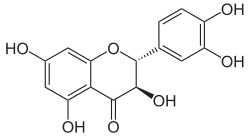
(+)-Taxifolin Allgemeines Name Taxifolin Andere Namen - (2R,3R)-(+)-Taxifolin
- 2,3-Dihydroquercetin
- 3,3',4',5,7-Pentahydroxyflavanon
- 3,3',4',5,7-Pentahydroxy-2,3-dihydroflavon
- (2R,3R)-2-(3,4-Dihydroxyphenyl)-2,3-dihydro- 3,5,7-trihydroxy-4H-1-benzopyran-4-on
Summenformel C15H12O7 CAS-Nummer 480-18-2 PubChem 439533 Kurzbeschreibung hellgelber, geruchloser Feststoff[1]
Eigenschaften Molare Masse 304,24 g·mol−1 Aggregatzustand fest
Schmelzpunkt Löslichkeit schlecht in Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] keine GHS-Piktogramme H- und P-Sätze H: keine H-Sätze EUH: keine EUH-Sätze P: keine P-Sätze EU-Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22 S: 22-45 LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Taxifolin ist eine organische Verbindung, im Reinzustand ein weißes Pulver, welches chemisch zu den natürlich vorkommenden Flavonoiden zählt, genauer ist es ein Flavanonol (vergleiche Nomenklatur der Flavonoide).
Pharmakologie
Antioxidative Wirkungen auf den Menschen sind, wie bei vielen Flavonoiden, nachgewiesen. Taxifolin besitzt – im Vergleich zum 2,3-ungesättigte Quercetin – nur etwa 50 % von dessen antioxidativer Wirkung. Das Vorhandensein einer ungesättigten Gruppe (wie der Enol-Funktion) und somit eine Möglichkeit der Stabilisierung energetisch ungünstiger Zustände scheint also ein wesentliches Merkmal antioxidativer Flavonoide zu sein.[6]
Die fehlende Doppelbindung am C-Ring hat wahrscheinlich auch zur Folge, dass Taxifolin nicht mutagen und kaum toxisch im Vergleich zu Qercetin wirkt.[7] Damit wird Taxifolin zu einem vielversprechenden Mittel bei der Chemoprävention von Krebs.[8] Es wurde beispielsweise nachgewiesen, dass unter anderem Taxifolin das Eierstock-Krebs-Zellwachstum in einer dosisabhängigen Weise hemmt.[9] Eine starke Korrelation besteht ebenso zwischen der hemmenden Wirkung von Taxifolin-(Dihydroquercetin oder DHQ)-Derivaten auf die Gewebevermehrung bei Maus-Zelllinien der Haut und bei menschlichen Brustkrebszellen.[10]
Epidemiologische und in vivo-Studien weisen auf einen positiven Einfluss bei verschiedenen Herz-Kreislauferkrankungen hin. Traditionell wurden diese Effekte nur den antioxidativen Aktivitäten zugeschrieben. Jedoch gibt es neben der unmittelbaren Bindung Reaktiver Sauerstoffspezies eine Vielzahl anderer Effekte, die in pharmakologisch erreichbaren Konzentrationen auch für den positiven kardiovaskulären Einfluss verantwortlich sein kann. Dazu gehören insbesondere die Hemmung der ROS-bildenden Enzyme, Hemmung der Thrombozytenfunktion, Hemmung der Leukozyten-Aktivierung, Bluthochdruck senkende und gefäßerweiternde Eigenschaften.[11]
Die Fähigkeit von Taxifolin zur Anregung der Fibrillenbildung und Förderung der Stabilität von Kollagenfasern kann in der Medizin ebenfalls zur Anwendung kommen.[12] Darüber hinaus hemmt Taxifolin die zelluläre Melanogenese so effektiv wie Arbutin, einem der am weitesten verbreiteten Mittel gegen Hypopigmentierung in Kosmetika. Jedoch wirkt Arbutin ebenso wie Quercetin äußerst mutagen, kanzerogen und toxisch.[13]
Auch zur Behandlung von Neurodermitis scheint Taxifolin vielversprechend zu sein. Es wurde eine Verhinderung der Produktion von inflammatorischen Zytokinen und eine Verringerung von Hautentzündungen beobachtet.[14]
Taxifolin reduziert signifikant die Produktion des blauen Farbstoffs Pyocyanin und des Enzyms Elastase im weitverbreiteten Krankenhauskeim Pseudomonas aeruginosa. Das Flavonoid hemmt somit auch die Virulenz krankheitsauslösender Bakterien durch Eingriff in ihren Quorum sensing-Mechanismus.[15]
Ebenso wurde durch Taxifolin die Wirksamkeit von herkömmlichen Antibiotika wie Levofloxacin und Ceftazidim in-vitro verbessert. Daraus ergibt sich die Möglichkeit zur kombinierten Behandlung von Patienten mit MRSA (Multi-resistenter Staphylococcus aureus)-Infektionen.[16]
Vorkommen und Gewinnung
Bestimmte Teile der Stämme von Nadelhölzern, insbesondere der Lärche, haben einen relativ hohen Anteil an Taxifolin (DHQ). Die phenolischen Inhaltsstoffe, in Zusammenhang mit pflanzlichen Stoffwechselreaktionen, sind ausschlaggebend für die natürliche Dauerhaftigkeit und Widerstandsfähigkeit des Holzes gegenüber Schädlingen, UV-Strahlung und Witterung. Bei der Lärche kommt hier konkret dem Taxifolin entscheidende Bedeutung zu. Die Gesamtheit an phenolischen Inhaltsstoffen geht über 3 bis 4 % nur selten hinaus. Im ersten Schritt der Gewinnung von Taxifolin werden die unteren Stammenden der Lärchen, die als Abfallprodukte bei der Holzproduktion anfallen, entrindet und zerhäckselt. Die folgenden Laboruntersuchungen geben Aufschluss über den Anteil der Späne an DHQ (Dihydroquercetin). Durch klassische Extraktionsverfahren wird Taxifolin mit einem Reinheitsgrad von max.85-88% erreicht. Nur die anschließende mehrstufige Flüssigkeitschromatographie (LC) führt zu einem Reinheitsgrad von nahezu 100%. Dieser arbeits- und somit kostenintensive Prozess ist notwendig, um unerwünschte Beimengungen wie Harze und andere Stoffe nachhaltig aus der gewonnenen Substanz zu entfernen.[17]
Einzelnachweise
- ↑ a b c d Datenblatt Taxifolin bei Carl Roth, abgerufen am 14. Dezember 2010.
- ↑ Datenblatt Taxifolin bei Sigma-Aldrich, abgerufen am 23. April 2011.
- ↑ Russian Pharmacology and Toxicology, 1975, Vol. 38, S. 213.
- ↑ a b Taxifolin bei ChemIDplus.
- ↑ Japanese Journal of Pharmacology, 1971, Vol. 21, S. 377.
- ↑ Böhm, H.; Boeing, H.; Hempel, J.; Raab, B.; Kroke, A. Flavonole, Flavone und Anthocyane als natürliche Antioxidantien der Nahrung und ihre mögliche Rolle bei der Prävention chronischer Erkrankungen. Zeitschrift für Ernährungswissenschaft 1998, 37, S. 147–163.
- ↑ Makena P.S. et al.: Comparative mutagenic effects of structurally similar flavonoids quercetin and taxifolin on tester strains Salmonella typhimurium TA102 and Escherichia coli WP-2 uvrA, Environmental and molecular mutagenesis. 2009 Jul;50(6), S. 451–459; PMID 19326464.
- ↑ Lee SB et al.: The chemopreventive effect of taxifolin is exerted through ARE-dependent gene regulation, Biological & pharmaceutical bulletin, 2007 Jun;30(6), S. 1074–1079; PMID 17541156.
- ↑ Luo H et al.: Inhibition of cell growth and VEGF expression in ovarian cancer cells by flavonoids, Nutrition and cancer. 2008;60(6), S. 800–809; PMID 19005980.
- ↑ Antiproliferative and antioxidant activity of new dihydroquercetin derivatives, Eksp Klin Farmakol. 2010 Sep;73(9), S. 39–42; PMID 21086652.
- ↑ Mladenka P, Zatloukalová L, Filipský T, Hrdina R. Cardiovascular effects of flavonoids are not caused only by direct antioxidant activity. Free Radic Biol Med. 2010 Sep 15;49(6):963-975; PMID 20542108.
- ↑ Tarahovsky YS et al.: Acceleration of fibril formation and thermal stabilization of collagen fibrils in the presence of taxifolin (dihydroquercetin), Bulletin of experimental biology and medicine, 2007 Dec; 144(6), S. 791–794; PMID 18856203.
- ↑ An SM et al.: Flavonoids, taxifolin and luteolin attenuate cellular melanogenesis despite increasing tyrosinase protein levels, Phytotherapy research : PTR 2008 Sep;22(9), S. 1200–1207: PMID 18729255.
- ↑ Ahn JY et al.: Effect of taxifolin glycoside on atopic dermatitis-like skin lesions in NC/Nga mice,Phytotherapy research 2010 Jul;24(7), S. 1071–1077: PMID 20041431.
- ↑ Vandeputte OM et al.: The flavanone naringenin reduces the production of quorum sensing-controlled virulence factors in Pseudomonas aeruginosa PAO1, Microbiology 2011 May 5: PMID 21546585.
- ↑ An J et al.: Antibacterial and synergy of a flavanonol rhamnoside with antibiotics against clinical isolates of methicillin-resistant Staphylococcus aureus (MRSA), Phytomedicine. 2011 Apr 3: PMID 21466953.
- ↑ Univ.-Prof. Dr. Rupert Wimmer, Universität für Bodenkultur, Wien; Wenn Lärchenholz rot sieht!
Wikimedia Foundation.
