- Tetramethylammoniumhydroxid
-
Strukturformel 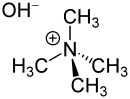
Allgemeines Name Tetramethylammoniumhydroxid Summenformel C4H13NO CAS-Nummer - 75-59-2 (wasserfrei)
- 10424-65-4 (Pentahydrat)
PubChem 60966 Kurzbeschreibung farblose, zerfließliche, stark Ammoniak-ähnlich riechende Nadeln [1]
Eigenschaften Molare Masse 91,15 g·mol−1 Aggregatzustand fest
Schmelzpunkt Dampfdruck Löslichkeit löslich in Wasser unter Bildung stark basischer Lösungen[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] Pentahydrat


Gefahr
H- und P-Sätze H: 300-311-314 EUH: keine EUH-Sätze P: 264-280-305+351+338-310 [3] EU-Gefahrstoffkennzeichnung [2] 
Giftig (T) R- und S-Sätze R: 24/25-34 S: 26-36/37/39-45 LD50 25 mg·kg−1 (Meerschweinchen, Haut) [4]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Tetramethylammoniumhydroxid (TMAH) ist eine quartäre Ammoniumverbindung.
Inhaltsverzeichnis
Eigenschaften
Chemische Eigenschaften
TMAH ist eine starke Base. Beim Erhitzen von TMAH erfolgt Zersetzung in Trimethylamin und Methanol.[1]
Verwendung
- In der Halbleiterfertigung beim anisotropen Ätzen von Silizium
- Als Lösungsmittel beim Entwickeln von sauren Photolacken
- Zur Verhinderung des Zusammenballens der Nanopartikel in einem Ferrofluid
- Als Derivatisierungsreagenz (Bildung von Methyl-Derivaten) in der chemischen Analytik
- Als Templat bei der Herstellung von synthetischen Zeolithen
Sicherheitshinweise
TMAH führt zu starker Reizung bis hin zu Verätzung der Augen, der Atemwege, der Lunge sowie der Haut.[1]
Das Tetramethylammonium-Kation (TMA) kann Nerven und Muskeln schädigen, was innerhalb von kürzester Zeit zu Atemlähmungen und schließlich zum Tod führen kann.[5]
Einzelnachweise
- ↑ a b c Thieme Chemistry (Hrsg.): Römpp Online. Version 3.1. Georg Thieme Verlag, Stuttgart 2007.
- ↑ a b c d Eintrag zu Tetramethylammoniumhydroxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 6. Juni 2008 (JavaScript erforderlich)
- ↑ a b Datenblatt Tetramethylammonium hydroxide pentahydrate bei Sigma-Aldrich, abgerufen am 24. April 2011.
- ↑ Tetramethylammoniumhydroxid bei ChemIDplus
- ↑ Wu, C.L. et al. (2008): Mortality from dermal exposure to tetramethylammonium hydroxide. In: J. Occup. Health. 50(2):99-102. PMID 18403859 PDF
Wikimedia Foundation.
