- Vanadium(IV)-chlorid
-
Strukturformel 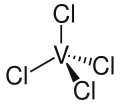
Allgemeines Name Vanadium(IV)-chlorid Andere Namen - Vanadiumtetrachlorid
- Vanadin(IV)-chlorid
- Vanadintetrachlorid
Summenformel VCl4 CAS-Nummer 7632-51-1 Kurzbeschreibung rötlich-braune Flüssigkeit mit stechendem Geruch[1]
Eigenschaften Molare Masse 192,75 g·mol−1 Aggregatzustand flüssig
Dichte 1,82 g·cm−3[1]
Schmelzpunkt Siedepunkt 148,5 °C[1]
Dampfdruck Löslichkeit zersetzt sich in Wasser mit heftiger Reaktion[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 

Gefahr
H- und P-Sätze H: 301-311-314-331 EUH: keine EUH-Sätze P: 261-280-301+310-305+351+338-310 [2] EU-Gefahrstoffkennzeichnung [1] 
Giftig (T) R- und S-Sätze R: 14-25-34 S: 8-20-26-30-36/37/39-43-45-60 LD50 160 mg·kg−1 (Ratte, oral)[3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Vanadium(IV)-chlorid ist eine chemische Verbindung aus der Gruppe der Chloride. Sie liegt in Form einer instabilen, nicht brennbaren, rötlich braunen Flüssigkeit mit stechendem Geruch vor. Bei Einwirkung von Licht oder Luftfeuchtigkeit zersetzt sie sich unter Bildung von Chlorgas bzw. Chlorwasserstoff.
Inhaltsverzeichnis
Gewinnung und Darstellung
Vanadium(IV)-chlorid wird durch Chlorierung von Vanadium bei etwa 300–350 °C gewonnen.
Eigenschaften
Vanadium(IV)-chlorid ist ein starkes Oxidationsmittel.
Vanadium(IV)-chlorid gibt bei Raumtemperatur langsam Chlor ab, da es in das Trichlorid disproportioniert[4]:
Verwendung
Vanadium(IV)-chlorid wird zur Herstellung von anderen Vanadiumverbindungen, sowie bei organischen Synthesen und als Katalysator bei Polymerisationen von Alkenen verwendet. So zum Beispiel zur Kopplung von Phenolen:
Sicherheitshinweise
Vanadium(IV)-chlorid zersetzt sich in Wasser mit heftiger Reaktion. Es ist als Krebserzeugend und Keimzellmutagen Kategorie 2 eingestuft.
Einzelnachweise
- ↑ a b c d e f g Eintrag zu CAS-Nr. 7632-51-1 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 11. August 2008 (JavaScript erforderlich)
- ↑ a b Datenblatt Vanadium(IV) chloride bei Sigma-Aldrich, abgerufen am 25. April 2011.
- ↑ MSDS (Stratcor)
- ↑ Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1548.
VanadiumhalogenideOxidationsstufe (II): Vanadium(II)-fluorid | Vanadium(II)-chlorid | Vanadium(II)-bromid | Vanadium(II)-iodid
Oxidationsstufe (III): Vanadium(III)-fluorid | Vanadium(III)-chlorid | Vanadium(III)-bromid | Vanadium(III)-iodid
Andere Oxidationsstufen: Vanadium(IV)-fluorid | Vanadium(IV)-chlorid | Vanadium(IV)-bromid | Vanadium(V)-fluorid
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
Vanadium(III)-chlorid — Kristallstruktur V3+ … Deutsch Wikipedia
Vanadium(II)-chlorid — Kristallstruktur V2+ … Deutsch Wikipedia
Vanadium(III)-bromid — Kristallstruktur V3+ … Deutsch Wikipedia
Vanadium(III)-fluorid — Kristallstruktur Allgemeines Name Vanadium(III) fluorid … Deutsch Wikipedia
Vanadium(IV)-fluorid — Kristallstruktur Keine Kristallstruktur vorhanden Allgemeines Name Vanadium(IV) fluorid Andere Namen Vanadiumtetrafluorid Vanadin(IV) fluorid Vanadintetrafluorid … Deutsch Wikipedia
Vanadium — Eigenschaften … Deutsch Wikipedia
Vanadium(III)-iodid — Kristallstruktur V3+ … Deutsch Wikipedia
Vanadium(V)-fluorid — Kristallstruktur V5+: F … Deutsch Wikipedia
Vanadium(II)-bromid — Kristallstruktur V2+ … Deutsch Wikipedia
Vanadium(II)-fluorid — Kristallstruktur V2+ … Deutsch Wikipedia



