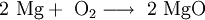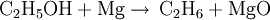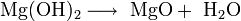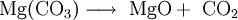- Weiße Magnesia
-
Kristallstruktur 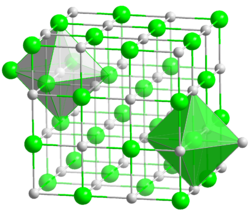
__ Mg2+ __ O2- Kristallsystem kubisch Raumgruppe 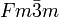
Koordinationszahlen Mg[6], O[6] Allgemeines Name Magnesiumoxid Andere Namen - Magnesia
- Magnesia usta
Verhältnisformel MgO CAS-Nummer 1309-48-4 ATC-Code Kurzbeschreibung farblose Kristalle Eigenschaften Molare Masse 40,32 g/mol Aggregatzustand fest
Dichte 3,58 g·cm−3 (25 °C)[1]
Schmelzpunkt Siedepunkt ~3600 °C[1]
Löslichkeit praktisch unlöslich in Wasser[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Magnesiumoxid (Magnesia) ist das Oxid des Magnesiums. Das Salz besitzt die Formel MgO und besteht aus Mg2+- und O2−-Ionen. Es kristallisiert in der Natriumchlorid-Struktur.
Inhaltsverzeichnis
Vorkommen
In der Natur kommt Magnesiumoxid als vulkanisches Mineral Periklas vor und wird auch als Bittererde bezeichnet. Es sind graue bis dunkelgrüne, glasglänzende reguläre Kristalle der Härte 5,5 bis 6 (nach Mohs).
Darstellung und Gewinnung
Magnesiumoxid entsteht durch das Verbrennen von Magnesium an der Luft.
Es kann auch durch die Reaktion von Ethanoldampf aus Magnesium bei erhöhter Temperatur erhalten werden. Hierbei entsteht neben Magnesiumoxid Ethan.
Weiterhin wird MgO durch Kalzinierung von Magnesiumhydroxid Mg(OH)2 oder Magnesiumcarbonat MgCO3) gewonnen, beispielsweise als Nebenprodukt bei der Meerwasseraufbereitung, bei dem durch Fällung mit Calciumhydroxid Magnesiumhydroxid gewonnen wird.
Eigenschaften
Magnesiumoxid bildet farblose Kristalle in der Natriumchlorid-Struktur. Es besitzt einen hohen Schmelzpunkt von etwa 2800 °C. Wird es aus der thermischen Umsetzung anderer Magnesiumverbindungen gewonnen, so hängt das chemische Verhalten sehr stark von Herstellungstemperatur und Herstellungsverfahren ab. Beim Kalzinieren von natürlich vorkommendem Magnesiumcarbonat (Magnesit) bei etwa 800 °C entsteht sogenannter „kaustisch gebrannter Magnesit“. Während des Brennvorgangs entweicht das Kohlenstoffdioxid, jedoch ist die Temperatur zu niedrig, um ein Sintern zuzulassen. Die entstehenden Magnesiumoxidkörner haben daher noch die äußere Form des Magnesiumcarbonats, sind porös und durch die große innere Oberfläche sehr reaktionsfähig. Mit Wasser entsteht in kurzer Zeit Magnesiumhydroxid. Die Reaktion einiger in Wasser gelöster Magnesiumsalze mit kaustisch gebranntem Magnesit führt zur Auskristallisation einer steinharten Masse. Ist das Magnesiumsalz Magnesiumchlorid MgCl2, so spricht man von Sorelzement.
Bei 1700 °C bis 2000 °C bildet sich Sintermagnesia, oberhalb von 2800 °C Schmelzmagnesia. Beide Sorten reagieren kaum noch mit Wasser.
Verwendung
Es wird Lebensmitteln als Säureregulator oder Trennmittel zugesetzt. Es ist in der EU als Lebensmittelzusatzstoff der Bezeichnung E 530 ohne Höchstmengenbeschränkung (quantum satis) für Lebensmittel allgemein zugelassen.
Sorelzement wird für die Herstellung von Industriefußböden verwendet. Weiterhin wird kaustisch gebrannter Magnesit in der Dünge- und Futtermittelindustrie als Magnesiumträger verwendet. Auch wird Magnesiumoxid zur Substitutionstherapie verwendet. Magnesiumoxid wird im Turnsport als Antitranspirator der Hände verwendet, um die Abrutschgefahr durch feuchte Hände zu vermindern.
Sintermagnesia wird wegen seiner Feuerfestigkeit (Schmelzpunkt 2800 °C) für Ofenauskleidungen und Laborgeräte verwendet. Magnesia wird zur Erzeugung basischer Feuerfestmaterialien für die Zementherstellung, zur Gewinnung von Buntmetallen, Stahlveredlern und Glas sowie zur Herstellung von Magnesia-Kohlenstoff-Steinen verwendet, dem wichtigsten Material zur Herstellung feuerfester Auskleidungen von Gefäßen zur Stahlherstellung (Konverter, Elektrolichtbogenofen und Gießpfanne). Ohne Magnesia sind diese Materialien mit modernen Methoden nicht herstellbar. Ebenso wurde dieser Stoff wegen seiner Hitzefestigkeit in der Vergangenheit für Isolierröhrchen zwischen Heizfaden und Kathode von Elektronenröhren verwendet.
Magnesiumoxid wird auch zur Entkieselung von Wasser, so wie als Adsorptionsmittel und Vulkanisierungsverzögerer in der organischen Chemie eingesetzt.
Quellen
Wikimedia Foundation.