- Berylliumhydrid
-
Strukturformel 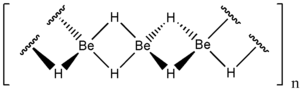
Allgemeines Name Berylliumhydrid Andere Namen Berylliumwasserstoff
Summenformel BeH2 CAS-Nummer 7787-52-2 Kurzbeschreibung Weißes Pulver
Eigenschaften Molare Masse 11,03 g/mol Aggregatzustand fest
Dichte 0,65 g·cm−3 (25 °C)[1]
Schmelzpunkt Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 


Gefahr
H- und P-Sätze H: 350i-330-301-372-319-335-315-317-411 EUH: keine EUH-Sätze P: ? EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Sehr giftig Umwelt-
gefährlich(T+) (N) R- und S-Sätze R: 49-25-26-36/37/38-43-48/23-51/53 S: 45-53-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Berylliumhydrid ist eine chemische Verbindung bestehend aus den Elementen Beryllium und Wasserstoff. Es besitzt die Summenformel BeH2 und gehört zur Stoffgruppe der Hydride.
Inhaltsverzeichnis
Darstellung
Die Darstellung von Berylliumhydrid aus den Elementen Beryllium und Wasserstoff ist nicht möglich. Zweckmäßig ist die Gewinnung aus einer metallorganischen Berylliumverbindung und einem Hydrid wie beispielsweise Lithiumaluminiumhydrid (LiAlH4) oder Diboran. Die Reaktion wird in Diethylether durchgeführt, da das Produkt Berylliumhydrid nicht in Ether löslich ist und aus der Lösung ausfällt.
Ebenfalls möglich ist die Darstellung von Berylliumhydrid durch Thermolyse von Bis(tert-butyl)beryllium bei 210 °C:
Eigenschaften
Berylliumhydrid ist eine feste, weiße, nichtflüchtige, hochpolymere Substanz, welche oberhalb von 240 °C in ihre Elemente zerfällt. Es ist feuchtigkeits- und luftempfindlich und in den meisten organischen Lösungsmitteln unlöslich. In Wasser zersetzt es sich unter Bildung von Berylliumhydroxid.
Berylliumhydrid bildet ein kettenförmiges Polymer aus, bei dem jeder Berylliumkern tetraedrisch von vier Wasserstoffen umgeben ist. Dabei bildet es eine ähnliche Struktur mit kovalenten Dreizentrenbindungen wie Aluminiumhydrid aus.
Verwendung
Berylliumhydrid wird als Raketentreibstoff und als Moderator in Kernreaktoren eingesetzt.[4][5]
Einzelnachweise
- ↑ Carl L. Yaws: "Thermophysical Properties of Chemicals and Hydrocarbons", S. 298. (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Holleman-Wiberg: Lehrbuch der Anorganischen Chemie 102. Auflage, de Gruyter, Berlin, 2007.
- ↑ a b Nicht explizit in EU-Verordnung (EG) 1272/2008 (CLP) gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Berylliumverbindungen“; Eintrag in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13. März 2011 (JavaScript erforderlich)
- ↑ Dale L. Perry, Sidney L. Phillips: Handbook of inorganic compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 62 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Kenneth A. Walsh: "Beryllium chemistry and processing", ASM International (2009). p. 121 (Eingeschränkte Vorschau in der Google Buchsuche).
Kategorien:- Krebserzeugender Stoff
- Giftiger Stoff
- Sensibilisierender Stoff
- Umweltgefährlicher Stoff
- Berylliumverbindung
- Hydrid
- Polymer
Wikimedia Foundation.