- Butylgruppe
-
Die Butylgruppe ist eine Atomgruppierung der organischen Chemie. Sie gehört zu den Alkylgruppen[1] und leitet sich formal von der Struktur des Butans durch Abstraktion eines Wasserstoffs ab. Somit besitzt sie die Summenformel C4H9. Die Butylgruppe kann vier isomere Formen auftreten: n-Butyl-, sec-Butyl-, Isobutyl und tert-Butylgruppe. Während im Falle der n-Butyl- und der iso-Butylgruppe der Rest an einem primären Kohlenstoffatom gebunden ist, ist er im Falle der sec-Butylgruppe an einem sekundären, im Falle der tert-Butylgruppe an einem tertiären gebunden.
Inhaltsverzeichnis
Eigenschaften
Sterische Eigenschaften
Mit zunehmender Verzweigung erhöht sich der sterische Anspruch der Butylgruppen. Tert-Butylgruppen stellen sterisch anspruchsvolle Reste dar. Durch sie können chemische Verbindungen stabilisiert werden, da ein Angriff durch deren Raumerfüllung erheblich gehindert werden kann. Diese Hinderung wirkt sich auch auf die Reaktionskinetik aus, die sich hierdurch sowohl beschleunigen als auch verlangsamen kann. Laufen Reaktion, die den Angriff eines Reaktionspartners in der Umgebung der tert-Butylgruppe erfordern ab, so laufen diese Reaktionen meist deutlich langsamer ab, da der Angriff durch den raumerfüllenden Rest gehindert ist. Andersherum kann auch die Konformation eines Moleküls durch den tert-Butylrest in einer Position eingefroren werden, die der Reaktionskinetik zuträglich ist und somit die Reaktion beschleunigen. Die tert-Butylgruppe fungiert hierbei als Anker.
Ankergruppen
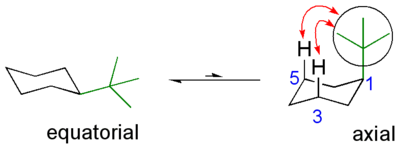
iso-Butyl- sowie tert-Butylgruppen können als Ankergruppen verwendet werden. Dies bedeutet, dass sie die durch ihren sterischen Effekt die Änderung der Konformation der Verbindung behindern. So schränken sie beispielsweise die freie Drehbarkeit von Alkylresten ein oder verhindern die Umwandlung der beiden Sesselkonformationen von Cyclohexanringen ineinander. Der sperrige tert-Butylrest bleibt hierbei bevorzugt in äquatorialer Position, da sich so die geringsten Wechselwirkungen mit anderen Substitutenten ergeben. In der zweiten möglichen Sesselkonformation befindet sich der Rest in einer axialen Position, wodurch sich Wechselwirkungen mit anderen axialen Substituenten ergeben (Prelog-Spannung). Da diese energetisch ungünstig sind, liegt dieses Gleichgewicht stark auf der Seite, auf der die tert-Butylgruppe eine äquatoriale Position einnimmt.
Elektronische Eigenschaften
Durch die unterschiedlichen Positionen, mit denen die Butylgruppe am Molekül bindet, ergeben sich verschiedene elektronische Eigenschaften, die durch die induktiven Effekte der Alkylreste verursacht werden. So ist unter den isomeren Butylresten die Elektronendichte am tertiären Kohlenstoff der tert-Butylgruppe am höchsten und an der n-Butylgruppe am niedrigsten. Dies spiegelt sich auch in der ansteigenden Basizität der lithiierten Spezies von n-Butyllithium über sec-Butyllithium zu tert-Butyllithium wider. Der gleiche Effekt ist auch für abfallende Azidität der alkoholischen Protonen der Butylalkohole, 1-Butanol, 2-Butanol und tert-Butanol verantwortlich.
Verwendung
Lithiumalkyle sind starke metallorganische Basen. Sie können zum deprotonieren schwach acider Protonen sowie zur Lithiierung verwendet werden. Kommerziell sind drei Butyllithiumbasen als Standardreagenzien erhältlich: n-Butyllithium, sec-Butyllithium, und tert-Butyllithium (aufsteigende Reaktivität). Die tert-Butylgruppe ist ein Bestandteil der bedeutsamen BOC-Schutzgruppe.[2]
Das Hydrierungsagens Diisobutylaluminiumhydrid (DIBAL) besitzt zwei Isobutylreste.
Verbindungsgruppen
Folgende Stoffgruppen enthalten alle vier Varianten der Butylgruppe als Substituenten:
Einzelnachweise
- ↑ Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag, Leipzig 1965, S. 46.
- ↑ Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart 1984, ISBN 3-7776-0406-2, S. 792.
Wikimedia Foundation.