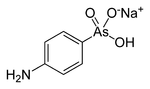
- Arsanilsäure
-
Strukturformel 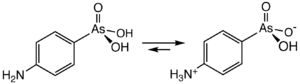
Allgemeines Name Arsanilsäure Andere Namen p-Arsanilsäure
Summenformel - C6H10AsNO3
- C6H9AsNNaO3 (Natriumhydrogenarsanilat)
CAS-Nummer - 98-50-0
- 127-85-5 (Natriumhydrogenarsanilat)
PubChem 23670523 DrugBank EXPT00575 Kurzbeschreibung kristallines Pulver (Natriumhydrogenarsanilat)[1]
Eigenschaften Molare Masse 217,05 g·mol−1 Aggregatzustand fest
Schmelzpunkt > 300 °C[2]
Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 

Gefahr
H- und P-Sätze H: 301-331-410 EUH: keine EUH-Sätze P: 261-273-301+310-311-501 [2] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Giftig Umwelt-
gefährlich(T) (N) R- und S-Sätze R: 23/25-50/53 S: (1/2)-20/21-28-45-60-61 LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Arsanilsäure (genauer p-Arsanilsäure) ist eine chemische Verbindung aus der Gruppe der organischen Arsensäurederivate (genauer der Derivate der Phenylarsonsäure). Ihr Ester und Salze werden als Arsanilate bezeichnet. Das Natriumsalz der Arsanilsäure Natrium-4-aminophenylhydrogenarsonat wurde Anfang des 20. Jahrhunderts als Wirkstoff auf Arsenbasis erprobt.
Eigenschaften
Arsanilsäure ist ein Derivat der Phenylarsonsäure mit einem Amin in der 4-Position. Sie existiert als Zwitterion, H3N+C6H4AsO3H−, obwohl sie in der Regel mit der nicht zwitterionischen Formel beschrieben wird.
Geschichte
Arsanilsäure wurde erstmals im Jahre 1863 von Antoine Béchamp durch Reaktion von Anilin mit Arsensäure dargestellt.[4]
Béchamp wählte den Namen Atoxyl, um auf die im Vergleich zum Arsen geringere Toxizität hinzuweisen. Zunächst wurde Atoxyl nur äußerlich gegen Hauterkrankungen eingesetzt.
Im Jahr 1906 erkannte der deutsche Mediziner und Nobelpreisträger Robert Koch auf einer Afrikaexpedition, dass Atoxyl auch die gefährliche Schlafkrankheit günstig beeinflussen kann. Die Wirkung war aber nicht sehr ausgeprägt, beziehungsweise die erforderliche Dosierung so hoch, dass toxische Nebenwirkungen des Arsenpräparates die zur Erblindung und sogar zum Tode führten überwogen.[5]
Dennoch war diese Entdeckung später für den Bakteriologen Paul Ehrlich eine wichtige Grundlage zur Entwicklung des Arsphenamins, dem ersten Medikament zur Behandlung der Syphilis.
Im Jahr 2000 in den USA und 2002 auch in Europa wurde Natriumhydrogenarsanilat unter dem Handelsnamen Atoxyl® zur Behandlung der Akuten Promyelozyten-Leukämie (APL) zugelassen.[6]
Einzelnachweise
- ↑ a b c Datenblatt Sodium 4-Aminophenylarsonate bei TCI Europe, abgerufen am 27. Juni 2011.
- ↑ a b c d e Datenblatt p-Arsanilic acid bei Sigma-Aldrich, abgerufen am 14. April 2011.
- ↑ Nicht explizit in RL 67/548/EWG, Anh. I gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Arsenverbindungen“; Eintrag in der GESTIS-Stoffdatenbank des IFA, abgerufen am 31. März 2009 (JavaScript erforderlich)
- ↑ W. Lee Lewis and H. C. Cheetham (1941), "Arsanilic Acid", Org. Synth.; Coll. Vol. 1: 70.
- ↑ Wolfgang U Eckart: Illustrierte Geschichte der Medizin. Springer, 2010, ISBN 978-3642126093 (Seite 308 in der Google Buchsuche).
- ↑ DAZ-online, Nr. 22/2008.

Bitte den Hinweis zu Gesundheitsthemen beachten! Kategorien:- Giftiger Stoff
- Umweltgefährlicher Stoff
- Antiprotozoikum
- ATC-P01
- Arzneistoff
- Natriumverbindung
- Organoarsenverbindung
- Aminobenzol
Wikimedia Foundation.