- Bortrichlorid
-
Strukturformel 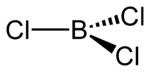
Allgemeines Name Bortrichlorid Andere Namen - Borchlorid
- Trichlorboran
Summenformel BCl3 CAS-Nummer 10294-34-5 PubChem 25135 Kurzbeschreibung farbloses Gas[1]
Eigenschaften Molare Masse 117,17 g·mol−1 Aggregatzustand gasförmig
Dichte Schmelzpunkt Siedepunkt 12,6 °C[1]
Dampfdruck Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 


Gefahr
H- und P-Sätze H: 330-314-280-300 EUH: 014-071 P: 260-280-304+340-303+361+353-305+351+338-315-405-403 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Sehr giftig (T+) R- und S-Sätze R: 14-26/28-34 S: (1/2)-9-26-28-36/37/39-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Bortrichlorid ist eine gasförmige chemische Verbindung aus der Gruppe der Bor-Halogen-Verbindungen bzw. anorganischen Chlorverbindungen.
Inhaltsverzeichnis
Gewinnung und Darstellung
Bortrichlorid wird industriell durch direkte Chlorierung von Bortrioxid und Kohlenstoff bei 500 °C gewonnen.[4]
Diese Synthese ist analog zum Kroll-Prozess.
Alternativ ist auch die Synthese direkt aus Borsäure über den Zwischenschritt von Triphenylbor möglich.[4]
Ebenfalls möglich ist eine Direktsynthese aus den Elementen Bor und Chlor.
Eigenschaften
Bortrichlorid ist ein unbrennbares, farbloses, an feuchter Luft durch Bildung von Chlorwasserstoff-Nebel stark rauchendes Gas.
Bei Kontakt mit Wasser reagiert es heftig unter Bildung von Salzsäure und Borsäure:
Bei Erhitzung zersetzt sich die Verbindung, wobei Chlor und Chlorwasserstoff entstehen. Der kritische Punkt liegt bei 178,8 °C, 38,7 bar und 0,790 kg/l; der Tripelpunkt bei −107 °C und 0,373 mbar.[1] Bortrichlorid ist eine Lewis-Säure und reagiert leicht mit tertiären Aminen, Phosphinen, Ethern, Thioethern und Halogenid-Ionen.[5] Es besitzt eine Verdampfungswärme von 203 kJ/kg, spezifische Wärmekapazität von 0,5345 kJ/(kg·K) und eine Wärmeleitfähigkeit von 110·10−4 W/(m·K) (als Gas bei 25 °C und 1 bar Druck).[6]
Verwendung
Bortrichlorid wird als Katalysator, zur Synthese anderer chemischer Verbindungen (z. B. Borazin), für Chlorierungen, zur Beseitigung von Nitriden, Carbiden und Oxiden aus Schmelzen von Aluminium-, Magnesium-, Zinn- und Kupferlegierungen sowie zur Dotierung von Halbleitern verwendet.[1]
Einzelnachweise
- ↑ a b c d e f g h i j Eintrag zu CAS-Nr. 10294-34-5 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. Juli 2011 (JavaScript erforderlich).
- ↑ Datenblatt Bortrichlorid bei Merck, abgerufen am 1. April 2010.
- ↑ Eintrag zu CAS-Nr. 10294-34-5 im European chemical Substances Information System ESIS
- ↑ a b Georg Brauer: Handbuch der präparativen anorganischen Chemie, ISBN 3-432-87813-3.
- ↑ W. Gerrard, M. F. Lappert: Reactions Of Boron richloride With Organic Compounds. In: Chemical Reviews. 1958, 58, S. 1081–1111, doi:10.1021/cr50024a003.
- ↑ Datenblatt (Messer).
Schlagen Sie auch in anderen Wörterbüchern nach:
Bortrichlorid — Bor|tri|chlo|rid; Syn.: Trichlorboran: BCl3; farbloses, giftiges, an Luft rauchendes Gas, Sdp. 12 °C, das haupts. als Katalysator u. zur Herst. von Borfasern eingesetzt wird … Universal-Lexikon
Plasma-Ätzen — Plasmaätzen ist ein materialabtragendes, plasmaunterstütztes, gaschemisches Trockenätz Verfahren, das besonders in der Halbleitertechnik, Mikrostrukturtechnologie und in der Displaytechnik großtechnisch eingesetzt wird. Der Begriff Plasmaätzen… … Deutsch Wikipedia
Plasmaätzen — ist ein materialabtragendes, plasmaunterstütztes, gaschemisches Trockenätz Verfahren, das besonders in der Halbleiter , Mikrosystem und Displaytechnik großtechnisch eingesetzt wird. Der Begriff Plasmaätzen ist ein eher umgangssprachlicher Begriff … Deutsch Wikipedia
RIE-Prozess — Plasmaätzen ist ein materialabtragendes, plasmaunterstütztes, gaschemisches Trockenätz Verfahren, das besonders in der Halbleitertechnik, Mikrostrukturtechnologie und in der Displaytechnik großtechnisch eingesetzt wird. Der Begriff Plasmaätzen… … Deutsch Wikipedia
Anorganische Säurehalogenide — Als anorganische Säurehalogenide werden in der Chemie funktionelle Derivate anorganischer sauerstoffhaltiger Säuren bezeichnet, die sich aus den empirischen Formeln durch Ersatz der Hydroxygruppe –OH durch ein Halogenatom (Fluor, Chlor, Brom oder … Deutsch Wikipedia
Borverbindungen. — Borverbindungen. Das Boratom hat drei Elektronen in der Außenschale (Elektronenkonfiguration 2s22p) und tritt daher in seinen Verbindungen dreiwertig auf. Es bildet jedoch im Gegensatz zu dem im Periodensystem unter ihm stehenden Aluminium kein … Universal-Lexikon
B2H6 — Strukturformel Allgemeines Name Diboran Andere Namen Borethan Diborhexahydrid … Deutsch Wikipedia
B3H6N3 — Strukturformel Allgemeines Name Borazin Andere Namen Cyclotriborazan Borazol … Deutsch Wikipedia
Bor — Eigenschaften … Deutsch Wikipedia
Borazin — Strukturformel Allgemeines Name Borazin Andere Namen … Deutsch Wikipedia



