- Lithiumborhydrid
-
Strukturformel 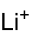
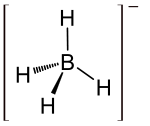
Allgemeines Name Lithiumborhydrid Andere Namen - Lithiumboranat
- Lithiumtetrahydroborat
- Lithiumtetrahydridoborat
Summenformel LiBH4 CAS-Nummer 16949-15-8 PubChem 4148881 Kurzbeschreibung hygroskopischer, weißer bis grauer Feststoff[1]
Eigenschaften Molare Masse 21,78 g·mol−1 Aggregatzustand fest
Dichte 0,6660 g·cm−3[1]
Schmelzpunkt 280 °C[1]
Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 


Gefahr
H- und P-Sätze H: 260-301-311-314-331 EUH: keine EUH-Sätze P: 223-231+232-261-280-370+378-422 [3] EU-Gefahrstoffkennzeichnung [1] 

Leicht-
entzündlichGiftig (F) (T) R- und S-Sätze R: 14/15-25-34 S: 8-26-36/37/39-43-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Lithiumborhydrid ist eine chemische Verbindung aus der Gruppe der Lithiumverbindungen und Borane.
Inhaltsverzeichnis
Gewinnung und Darstellung
Lithiumborhydrid kann durch eine Metathese-Reaktion von Natriumborhydrid und Lithiumbromid erzeugt werden.[4]
Die direkte Bildung aus metallischem Lithium, Bor und Wasserstoff ist im Prinzip möglich, erfordert aber extreme Bedingungen (150 at Wasserstoffdruck, 650 °C).[5]
Auch die Herstellung aus (intermediärem) Diboran (zum Beispiel aus Lithiumhydrid mit Bortrifluorid in Diethylether) ist möglich.[5][2]
Eigenschaften
Lithiumborhydrid ist ein brennbarer, hygroskopischer, weißer bis grauer Feststoff. Er zersetzt sich bei Kontakt mit Wasser oder feuchter Luft und bildet dabei Wasserstoff.[1]
Verwendung
Lithiumborhydrid wird als Reduktionsmittel für Aldehyde, Ketone, Lactone, Epoxide und Ester in der organischen Chemie verwendet.[1]
Einzelnachweise
- ↑ a b c d e f g Eintrag zu CAS-Nr. 16949-15-8 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Juli 2010 (JavaScript erforderlich).
- ↑ a b Georg Brauer: Handbuch der präparativen anorganischen Chemie. Band 2, S. 793; ISBN 3-432-87813-3.
- ↑ a b Datenblatt Lithium borohydride bei Sigma-Aldrich, abgerufen am 7. April 2011.
- ↑ Peter Rittmeyer, Ulrich Wietelmann: Hydrides. In Ullmann's Encyclopedia of Industrial Chemistry. 2002, Wiley-VCH, Weinheim, doi:10.1002/14356007.a13_199.
- ↑ a b Verfahren zur Herstellung von Lithiumborhydrid
Kategorien:- Giftiger Stoff
- Feuergefährlicher Stoff
- Lithiumverbindung
- Hydrid
- Borverbindung
Wikimedia Foundation.



