- Nitroniumtetrafluoroborat
-
Strukturformel 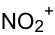
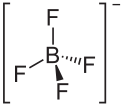
Allgemeines Name Nitroniumtetrafluoroborat Summenformel NO2BF4 CAS-Nummer 13826-86-3 Kurzbeschreibung farbloser Feststoff[1]
Eigenschaften Molare Masse 132,81 g·mol−1 Aggregatzustand fest
Schmelzpunkt Löslichkeit Zersetzung in Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 

Gefahr
H- und P-Sätze H: 314-317-334 EUH: keine EUH-Sätze P: 261-280-305+351+338-310 [2] EU-Gefahrstoffkennzeichnung [1] 
Ätzend (C) R- und S-Sätze R: 34 S: 26-36/37/39-45 MAK 2,5 mg·m−3[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Nitroniumtetrafluoroborat ist eine chemische Verbindung. Es handelt sich um das Tetrafluorborat-Salz des Nitroniumions.
Darstellung
Das Salz kann durch Reaktion von wasserfreier Fluorwasserstoffsäure mit Bortrifluorid und Distickstoffpentoxid in Nitromethan hergestellt werden.[3]
Verwendung
Nitroniumtetrafluoroborat wird als reaktives Reagenz zur Nitrierung von Aromaten verwendet. Nitrierungen laufen mit diesem Salz besser und unter milderen Bedingungen ab als mit dem herkömmlichem Protokoll zur Nitrierung, in welchem Nitroniumionen in situ aus Salpetersäure und Schwefelsäure hergestellt werden. Es nitriert Benzol zu Nitrobenzol[4] und selbst 2,6-Dibrompyridin[5].
Einzelnachweise
- ↑ a b c d e Datenblatt Nitroniumtetrafluoroborat bei AlfaAesar, abgerufen am 2. März 2010 (JavaScript erforderlich).
- ↑ a b Datenblatt Nitronium tetrafluoroborate bei Sigma-Aldrich, abgerufen am 16. April 2011.
- ↑ K. Schofield: Aromatic nitration, 1. Auflage, S. 88, Cambridge University Press, Cambridge, S. 88, ISBN 0521233623.
- ↑ J. Buddrus: Grundlagen der Organischen Chemie, 3. Auflage, S. 344, de Gruyter Verlag, 2003, ISBN 3-110-14683-5.
- ↑ J. L. Duffy, K. K. Laali: Aprotic Nitration (NO2+BF4−) of 2-Halo- and 2,6-Dihalopyridines and Transfer-Nitration Chemistry of Their N-Nitropyridinium Cations, in: J. Org. Chem. 1991, 56, 3006–3009; doi:10.1021/jo00009a015.
Kategorien:- Sensibilisierender Stoff
- Ätzender Stoff
- Stickstoffverbindung
- Sauerstoffverbindung
- Fluorverbindung
- Borverbindung
Wikimedia Foundation.
