- Risedronsäure
-
Strukturformel 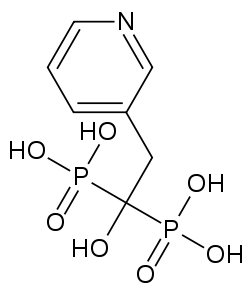
Allgemeines Freiname Risedronsäure Andere Namen Summenformel - C7H11NO7P2
- C7H10NNaO7P2 (Risedronat·Natrium)
CAS-Nummer - 105462-24-6 (Risedronsäure)
- 115436-72-1 (Risedronat·Natrium)
PubChem 5245 ATC-Code DrugBank DB00884 Kurzbeschreibung feines, weißes bis gebrochen weißes, geruchloses, kristallines Pulver (Risedronat·Natrium) [1]
Arzneistoffangaben Wirkstoffklasse Verschreibungspflichtig: ja Eigenschaften Molare Masse Löslichkeit löslich in Wasser; im Wesentlichen unlöslich in gängigen organischen Lösungsmitteln (Risedronat·Natrium) [1]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln EU-Gefahrstoffkennzeichnung [2] Keine Einstufung verfügbarR- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Risedronsäure INN – auch Risedronat USAN – (Handelsname Actonel®), ist ein Arzneistoff aus der Gruppe der Bisphosphonate und wird als Natriumsalz insbesondere zur Behandlung der Osteoporose eingesetzt.[3]
Inhaltsverzeichnis
Klinische Angaben
Anwendungsgebiete (Indikationen)
Risedronsäure wird als Natriumrisedronat wird bei Frauen zur Behandlung der Osteoporose nach der Menopause zur Verringerung des Risikos für Hüft- und Wirbelkörperfrakturen sowie bei Männern zur Behandlung der Osteoporose bei erhöhtem Frakturrisiko eingesetzt. Darüber hinaus beisteht eine Arzneimittelzulassung für die Erhöhung der Knochenmasse bei Risikopatienten, die über einen längeren Zeitraum systemische Glucocorticoide in höherer Dosis einnehmen.[4][5]
Ein weiterer zugelassener Anwendungsbereich für Risedronsäure ist die Behandlung des Paget-Syndroms.[6][7]
Gegenanzeigen (Kontraindikationen)
Die Anwendung von Risedronsäure ist bei einer bekannten Überempfindlichkeit gegen diesen Wirkstoff, bei einer Hypokalziämie, in der Schwangerschaft und Stillzeit sowie bei Vorliegen einer schweren Nierenfunktionsstörung mit einer Kreatinin-Clearance von unter 30 ml/min absolut kontraindiziert. Da Risedronsäure, wie auch andere Bisphosphonate, mit einer Häufung von Ösophagitis, Gastritis sowie Ösophagus- und gastroduodenalen Ulzera in Verbindung gebracht wird, sollten Vorsichtsmaßnahmen bei Patienten mit diesen Erkrankungen sowie bei Patienten, die sich nicht mindestens 30 Minuten nach Einnahme in aufrechter Position aufhalten können, getroffen werden.[4]
Wechselwirkungen
Wie bei anderen Arzneistoffen aus der Gruppe der Bisphosphonate führt eine gleichzeitige Einnahme von Arznei- und Lebensmitteln, die mehrwertige Kationen, wie beispielsweise Magnesium, Calcium, Eisen und Aluminium, enthalten, zu einer verringerten Aufnahme des Wirkstoffs. Bei gleichzeitiger Anwendung von nichtsteroidalen Antirheumatika, wie beispielsweise Acetylsalicylsäure, Ibuprofen und Diclofenac, kann das Risiko von Störungen des Magen-Darm-Trakts erhöht sein.[4]
Nebenwirkungen
Unter der Anwendung von Risedronsäure können am häufigsten Störungen des Magen-Darm-Trakts, wie Verstopfung, Verdauungsstörungen, Übelkeit, Bauchschmerzen und Durchfall mit einer Häufigkeit von 1–10 % beobachtet werden. Gelegentlich (0,1–1 %) treten Gastritis, Ösophagitis, Dysphagie, Duodenitis und Ösophagusulcus sowie selten (0,01–0,1 %) Glossitis und Ösophagusstriktur auf. Darüber hinaus konnten häufig (1–10 %) Kopfschmerzen und Schmerzen im Skelett- und Muskelbereich beobachtet werden.[4]
Pharmakologie
Pharmakodynamik (Wirkmechanismus)
Risedronsäure übt wie andere Bisphosphonate auf zwei Wegen Effekte auf den Knochen aus. Risedronsäure hemmt durch Anlagerung an den Knochen-Hydroxylapatit an der Knochenoberfläche den Knochenumsatz. Zusätzlich erfolgt eine Hemmung des Knochenabbaus durch Hemmung der Osteoklasten.[8]
Pharmakokinetik
Nach oraler Verabreichung wird nur ein relativ kleiner Teil des Risedronats in den systemischen Kreislauf aufgenommen. Die systemische Bioverfügbarkeit liegt bei etwa 0,6 %. Eine Verstoffwechslung im Körper erfolgt nicht. Risedronsäure wird aus den Körper heraus in drei Phasen ausgeschieden. Die terminale Plasmahalbwertzeit liegt bei über 400 Stunden.[9] Daher ist eine tägliche Gabe der Substanz nicht nötig, wenn die Einzeldosis entsprechend gewählt wird.[10]
Literatur
- Rackoff P: Efficacy and safety of risedronate 150 mg once a month in the treatment of postmenopausal osteoporosis. In: Clinical Interventions in Aging. 4, 2009, S. 207–214. PMID 19503783. Volltext bei PMC: 2685242. Abgerufen am 10. Juli 2010.
Einzelnachweise
- ↑ a b The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, 14. Auflage (Merck & Co., Inc.), Whitehouse Station, NJ, USA, 2006; ISBN 978-0-911910-00-1.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Masud T, McClung M, Geusens P: Reducing hip fracture risk with risedronate in elderly women with established osteoporosis. In: Clinical Interventions in Aging. 4, 2009, S. 445–449. PMID 19966913. Volltext bei PMC: 2785868. Abgerufen am 10. Juli 2010.
- ↑ a b c d Warner Chilcott Deutschland GmbH: Fachinformation Actonel® einmal wöchentlich 35 mg Filmtabletten. Stand März 2010. Abgerufen am 12. Juli 2010.
- ↑ Warner Chilcott Deutschland GmbH: Fachinformation Actonel® 5 mg Filmtabletten. Stand März 2010. Abgerufen am 12. Juli 2010.
- ↑ Warner Chilcott Deutschland GmbH: Fachinformation Actonel® 30 mg Filmtabletten. Stand März 2010. Abgerufen am 12. Juli 2010.
- ↑ Langston AL, Ralston SH: Management of Paget's disease of bone. In: Rheumatology (Oxford, England). 43, Nr. 8, August 2004, S. 955–959. PMID 15187244. Abgerufen am 11. Juli 2010.
- ↑ Heinz Lüllmann, Klaus Mohr, Lutz Hein : Pharmakologie und Toxikologie, Stuttgart, 2006 S. 262-264
- ↑ Christoffel Jos van Boxtel,Budiono Santoso,I. Ralph Edwards: Drug Benefits and Risks: International Textbook of Clinical Pharmacology, 2008, S. 399
- ↑ Watts NB, Brown JP, Cline G: Risedronate on 2 consecutive days a month reduced vertebral fracture risk at 1year compared with historical placebo. In: Journal of Clinical Densitometry : the Official Journal of the International Society for Clinical Densitometry. 13, Nr. 1, 2010, S. 56–62. PMID 19942469. Abgerufen am 11. Juli 2010.
Weblinks
- Einträge im NIH-Studienregister
- S3-Leitlinie Prophylaxe, Diagnostik und Therapie der Osteoporose bei Erwachsenen der Empfehlungen des Dachverbandes Osteologie (DVO). In: AWMF online (Stand Oktober 2009)

Bitte den Hinweis zu Gesundheitsthemen beachten!
Wikimedia Foundation.
