- Tenuazonsäure
-
Strukturformel 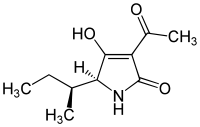
L-Tenuazonsäure Allgemeines Name Tenuazonsäure Andere Namen - (2R)-4-Acetyl-2-[(2R)-butan-2-yl]-5-hydroxy-1,2-dihydropyrrol-3-on
Summenformel C10H15NO3 CAS-Nummer 610-88-8 Eigenschaften Molare Masse 197,23 g·mol−1 Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] Die Angaben beziehen sich auf das Kupfer-Salz.

Gefahr
H- und P-Sätze H: 301 EUH: keine EUH-Sätze P: 301+310 [1] EU-Gefahrstoffkennzeichnung [1] Die Angaben beziehen sich auf das Kupfer-Salz.

Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22 S: keine S-Sätze LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Tenuazonsäure ist ein Schimmelpilzgift (Mykotoxin), das im Wesentlichen von Schimmelpilzen der Gattung Alternaria gebildet wird. Tenuazonsäure ist somit ein Vertreter aus der Stoffgruppe der Tetramsäuren. Die systematische chemische Bezeichnung für das chirale Molekül lautet (2R)-4-Acetyl-2-[(2R)-butan-2-yl]-5-hydroxy-1,2-dihydropyrrol-3-on, häufig wird jedoch auch L-Tenuazonsäure oder die Abkürzung L-TA verwendet.
Inhaltsverzeichnis
Geschichte
Tenuazonsäure wurde erstmals im Jahre 1958 aus einem Extrakt einer Alternaria tenuis Kultur isoliert.[4] Die Aufklärung der Molekularstruktur erfolgte ein Jahr später.[5]
Vorkommen
Tenuazonsäure wird hauptsächlich von Schimmelpilzen der Gattung Alternaria gebildet.[6] Allerdings produzieren auch Piricularia orycae[7][8] und Phoma sorghina[9] dieses Mykotoxin.
Biosynthese
Durch Experimente mit 14C-markiertem Acetat wurde nachgewiesen, dass Tenuazonsäure in Alternaria tenuis aus einem Molekül L-Isoleucin und zwei Molekülen Acetat biosynthetisiert wird.[10]
Biologische Bedeutung
Tenuazonsäure hat cytotoxische, antibakterielle[11], antivirale[2] und phytotoxische[12] Eigenschaften. Die biologische Aktivität der Tenuazonsäure ist laut einer in-vivo/in-vitro-Studie auf die Inhibierung der Proteinbiosynthese zurückzuführen, wobei die Freisetzung neu gebildeter Proteine aus den Ribosomen unterdrückt und der Einbau neuer Aminosäuren in Proteine verhindert wird.[13]
Vorkommen in Lebensmitteln
Wegen des weit verbreiteten Vorkommens von Alternaria spp. auf zur Lebensmittelproduktion verwendeten Pflanzen, lässt sich häufig auch das von diesem Schimmelpilz gebildete Mykotoxin Tenuazonsäure in verschiedenen Lebensmitteln nachweisen. Die folgende Liste gibt einen Überblick über die Lebensmittel, in denen Tenuazonsäure bisher schon nachgewiesen wurde:
Lebensmittel Mittlerer Gehalt an Tenuazonsäure Getreide[14][15] 1000–8000 µg kg−1 Getreideprodukte[16] 50 µg kg−1 Bier[17] 11 µg kg−1 Tomatenprodukte[18] 50–60 µg kg−1 Grenzwerte
Der Gesetzgeber hat noch keine Grenzwerte für Tenuazonsäure erlassen.
Analytik
Die Analytik von Tenuazonsäure kann durch chromatographische Methoden wie Dünnschichtchromatographie (DC), Gaschromatographie (GC) und Hochleistungsflüssigkeitschromatographie (HPLC) erfolgen, wobei die letztere Analysentechnik stark bevorzugt wird.[19] Allerdings ist die HPLC-Analytik von Tenuazonsäure prinzipiell dadurch limitiert, dass Tenuazonsäure auf Grund ihrer stark sauren und komplexbildenden Eigenschaften sehr schlechte chromatographische Eigenschaften aufweist. Durch den Zusatz von Zinksulfat oder anderen modifizierenden Zusätzen[19] zur mobilen Phase kann dies kompensiert werden. Da diese Additive bei Verwendung eines Massenspektrometers als Detektor (LC-MS) nicht geeignet sind, bietet sich in diesen Fällen die Derivatisierung von Tenuazonsäure als 2,4-Dinitrophenylhydrazon an.[16] Diese Derivatisierung ermöglicht eine sichere und präzise Bestimmung von Tenuazonsäure in Lebensmitteln mittels HPLC gekoppelt mit Tandem-Massenspektroskopie (LC-MS/MS). Matrixabhängige Schwankungen bei der Derivatisierung oder Ionisierung in der Ionenquelle des Massenspektrometers können am besten durch Verwendung eines stabilisotopenmarkierten internen Standards im Rahmen einer Stabilisotopenverdünnungsanalyse (SIVA) kompensiert werden. Für Tenuazonsäure wurde dies unter Verwendung von [13C6,15N]-Tenuazonsäure durchgeführt.[18]
Literatur
- Weidenbörner, M.: Lexikon der Lebensmittelmykologie. Springer-Verlag, 1999
Einzelnachweise
- ↑ a b c Sicherheitsdatenblatt Tenuazonsäure bei Sigma-Aldrich, abgerufen am 2. September 2011.
- ↑ a b c Miller, F. A. et al.; Nature, 200 (1963), S. 1338–1339
- ↑ Smith, E. R. et al.; Cancer Chemother. Rep. 52 (1968), S. 579–585.
- ↑ Rosett, T. et al.; Biochem J.; 67 (1957), S. 390–400
- ↑ Stickings, C. E. et al.; Biochem J. 72 (1958), S. 332–340
- ↑ Bottalico, A., Logrieco, A.; In: Mycotoxins in Agriculture and Food Safety; Marcel Dekker, Inc.: New York, NY, 1998, S. 65–108
- ↑ Umetsu, N. et al.; Agr Biol Chem; 38 (1974), 1867–1874
- ↑ Umetsu, N. et al.; Agr Biol Chem; 36 (1972), 859–866
- ↑ Steyn, P. S., Rabiet, C. J.; Phytochemistry 15 (1976), S. 1977–1979
- ↑ Stickings, C. E.; Townsend, R. J.; Biochem J.; 78 (1961), S. 412–418
- ↑ Gittermann, C. O.; J. Med. Chem. 8 (1965), S. 483–486
- ↑ Lebrun, M. H. et al.; Phytochemistry, 27 (1988), S. 77–84
- ↑ Shigeura, H. T., Gordon, C. N.; Biochemistry, 2 (1963), S. 1132–1137
- ↑ Azcarate, M. P. et al. J. Food Prot. 71 (2008), S. 1262–1265
- ↑ Li, F. Q. und Yoshizawa, T.; J. Agric. Food Chem. 48 (2000), 2920–2924
- ↑ a b Siegel, D. et al.; J. Chromatogr. A 1216 (2009), S. 4582–4588
- ↑ Siegel, D. et al.; Food Chem. 120 (2010), S. 902–906
- ↑ a b Asam, S. et al.; J. Agric. Food Chem. 59 (2011), S. 2980–2987
- ↑ a b Scott, P. M.; JAOAC Int. 84 (2001), S. 1809–1817
Wikimedia Foundation.
