- Vanadiumhexacarbonyl
-
Strukturformel 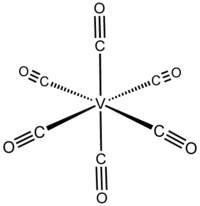
Allgemeines Name Vanadiumhexacarbonyl Andere Namen Vanadiumcarbonyl
Summenformel V(CO)6 CAS-Nummer 20644-87-5 PubChem 519800 Kurzbeschreibung bläulich-grüne Kristalle[1]
Eigenschaften Molare Masse 219,0 g·mol−1 Aggregatzustand fest[1]
Schmelzpunkt Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar H- und P-Sätze H: siehe oben EUH: siehe oben P: siehe oben EU-Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Vanadiumhexarbonyl ist ein Metallcarbonyl mit der chemischen Formel V(CO)6. Diese hochreaktive Spezies ist aus theoretischer und wissenschaftlicher Perspektive bemerkenswert. Es ist ein seltenes Beispiel eines isolierbaren homoleptischen Metallcarbonyls, das paramagnetisch ist.[3] Die meisten Metallcarbonyle mit der Formel Mex(CO)y folgen der 18-Elektronen-Regel, während V(CO)6 nur 17 Valenzelektronen aufweist.[3]
Inhaltsverzeichnis
Synthese
Traditionell wird V(CO)6 in zwei Schritten über die Zwischenstufe [HV(CO)6] hergestellt. In einem ersten Schritt wird VCl3 mit metallischen Natrium unter 200 atm CO bei 160 °C reduziert. Das Lösungsmittel für diese Reduktion ist in der Regel Diglyme, CH3OCH2CH2OCH2CH2OCH3. Dieser Triether löst Natriumsalze auf ähnliche Weise wie ein Kronenether:
Mittlerweile wurde von Ellis und Liu eine verbesserte Niederdruck-Synthese entwickelt.[4]
Eigenschaften
Physikalische Eigenschaften
Vanadiumhexacarbonyl ist eine bei Zimmertemperatur feste, kristalline Substanz von bläulich-grüner Farbe. Sie löst sich nicht in Wasser oder Ethanol, wenig in gesättigten Kohlenwasserstoffen wie Hexan aber gut in anderen organischen Lösungsmitteln unter Gelbfärbung der Lösung.[1] Die Wellenzahl der C-O-Streckschwingung νCO des freien Kohlenstoffmonoxids liegt bei 1976 cm−1.[3]
V(CO)6 hat eine oktaedrische Koordinationsgeometrie (Oh). Hochauflösende Röntgen-Kristallographie zeigt, dass das Molekül leicht verzerrt ist mit zwei kürzeren V-C-Bindungen von 199,3 pm und vier äquatorialen von 200,5 pm.[5] Eine solche Verzerrung könnte aufgrund des Jahn-Teller-Effekts entstanden sein.
Chemische Eigenschaften
V(CO)6 reagiert mit Cyclopentadienyl-Anionen zu einem orangefarbenen Komplex (C5H5)V(CO)4 (Smp. 136 °C). Wie viele ladungsneutrale metallorganische Verbindungen ist diese Halbsandwich-Verbindung leicht flüchtig.
V(CO)6 ist ein thermisch empfindliches Material. Seine primäre Reaktion ist die Reduktion zum Monoanion [V(CO)6]− sowie die Substitution durch Phosphane, häufig auch unter Disproportionierung. Vanadiumhexacarbonyl kann bei der Zersetzung toxische Verbindungen wie Kohlenstoffmonoxid und Vanadiumoxide freisetzen. Die Substanz ist eine pyrophore Verbindung, die beim Erhitzen explodieren kann.[1]
Verwendung
Vanadiumhexacarbonyl wird als Katalysator bei Isomerisierungs- und Hydrierungsreaktionen eingesetzt.[1]
Einzelnachweise
- ↑ a b c d e f g h i Pradyot Patnaik: A Comprehensive Guide to the Hazardous Properties of Chemical Substances. 3. Auflage, John Wiley and Sons, 2007, ISBN 978-0-47013494-8, S. 628.
- ↑ a b In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c Christoph Elschenbroich: Organometallchemie, 6. Auflage, Teubner, Wiesbaden 2008, ISBN 978-3-8351-0167-8, S. 330.
- ↑ X. Liu, J. E. Ellis: Hexacarbonylvanadate(1−) and Hexacarbonylvanadium(0). In: Inorganic Syntheses, 2004, Volume 34, ISBN 0-471-64750-0, S. 96–103 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ S. Bellard, K. A. Rubinson, G. M. Sheldrick: Crystal and molecular structure of vanadium hexacarbonyl. In: Acta Crystallographica, 1979, Volume B35, S. 271–274; doi:10.1107/S0567740879003332.
Literatur
- F. Calderazzo, R. Ercoli: Synthese von V(CO)6 und Hexacarbonylvanadaten. In: Chimica e l'Industria. 1962, Volume 44, S. 990–996.
Wikimedia Foundation.


![\mathrm{Na(digly)_2[V(CO)_6]\ +\ 3\ NaCl}](9/469c8f8504ff02f03890c089cbd985df.png)
![\mathrm{[V(CO)_6]^-\ +\ H^+\ \xrightarrow \ H[V(CO)_6]\ \xrightarrow \ V(CO)_6\ +\ H_2}](9/a3911016b67de9dd8af98a0e307331f5.png)