- Zinkfluorid
-
Kristallstruktur 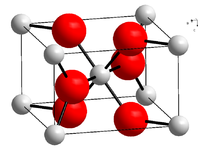
__ Zn2+ __ F− Allgemeines Name Zinkfluorid Andere Namen Zink(II)-fluorid
Verhältnisformel ZnF2 CAS-Nummer - 7783-49-5
- 13986-18-0 (Tetrahydrat)
PubChem 24551 Kurzbeschreibung durchsichtige, giftige, monokline Kristalle[1]
Eigenschaften Molare Masse 103,27 g·mol−1 Aggregatzustand fest
Dichte 4,95 g·cm−3[2]
Schmelzpunkt Siedepunkt 1500 °C (Zersetzung)[2]
Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [5] 

Gefahr
H- und P-Sätze H: 315-318-335 EUH: keine EUH-Sätze P: 261-280-305+351+338 [5] EU-Gefahrstoffkennzeichnung [2] 
Giftig (T) R- und S-Sätze R: 25-36/37/38 S: 26-36/37-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Zinkfluorid ist eine chemische Verbindung von Zink und Fluor aus der Gruppe der Halogenide.
Inhaltsverzeichnis
Gewinnung und Darstellung
Zinkfluorid kann durch direkte Reaktion von Zink mit Fluor[6] oder durch Reaktion von Fluorwasserstoff mit Zink unter Entstehung von Wasserstoff (H2) gewonnen werden.[6] Es kommt auch als Tetrahydrat vor. Alternativ ist auch die Gewinnung aus Fluorwasserstoff und Zinkcarbonat möglich.[3]
Eigenschaften
Zinkfluorid hat eine Rutil-Kristallstruktur (Raumgruppe P42/mnm) mit sechs Zinkatomen was (im Gegensatz zu den anderen Zinkhalogeniden) zu einer ionischen Bindung und der schlechten Löslichkeit in Wasser führt.[6] Zinkfluorid hydrolysiert in heißen Wasser zu Zinkhydroxidfluorid Zn(OH)F.[7]
Verwendung
Zinkfluorid dient als Holzschutzmittel[8] und kann zur Herstellung von anderen Fluorverbindungen wie Phosphortrifluorid verwendet werden.
Sicherheitshinweise
Zinkfluorid und sein Tetrahydrat sind als giftig eingestuft.[2][4]
Weblinks
- Farbzentren-Untersuchungen an Zinkfluorid-Einkristallen
- Growth and structural characterization of ZnF2 epitaxial layers on Si
Einzelnachweise
- ↑ Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ a b c d e Datenblatt Zinkfluorid (wasserfrei) bei AlfaAesar, abgerufen am 15. August 2010 (JavaScript erforderlich).
- ↑ a b Brauer, Georg - Handbuch Der Präparativen Anorganischen Chemie, ISBN 3-432-02328-6.
- ↑ a b Datenblatt Zinkfluorid (Tetrahydrat) bei AlfaAesar, abgerufen am 15. August 2010 (JavaScript erforderlich).
- ↑ a b Datenblatt Zinc fluoride bei Sigma-Aldrich, abgerufen am 25. April 2011.
- ↑ a b c Norman N. Greenwood, A. Earnshaw: Chemistry of the Elements. 2. Auflage, Butterworth-Heinemann, Oxford 1997, ISBN 0-7506-3365-4.
- ↑ Studies on metal hydroxy compounds. I. Thermal analyses of zinc derivatives e-Zn(0H)2, Zn5(OH)8C12.H20, ß- ZnOHC1, and ZnOHF, K SRIVASTAVA, EA SECCO - Canadian Journal of Chemistry, 1967, S. 579–583.
- ↑ Riedel, Erwin - Anorganische Chemie.
ZinkhalogenideZinkfluorid | Zinkchlorid | Zinkbromid | Zinkiodid
Wikimedia Foundation.

