- Dimethylacetamid
-
Strukturformel 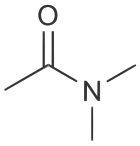
Allgemeines Name Dimethylacetamid Andere Namen - N,N-Dimethylacetamid
- DMAC
Summenformel C4H9NO CAS-Nummer 127-19-5 PubChem 31374 Kurzbeschreibung farblose bis gelbliche, hygroskopische Flüssigkeit mit schwach aminartigem Geruch[1]
Eigenschaften Molare Masse 87,12 g·mol−1 Aggregatzustand flüssig
Dichte 0,94 g·cm−3[1]
Schmelzpunkt Siedepunkt 165 °C[1]
Dampfdruck 3,3 mbar (20 °C)[1]
Löslichkeit mischbar mit Wasser und vielen organischen Lösungsmitteln[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 

Gefahr
H- und P-Sätze H: 360D-332-312 EUH: keine EUH-Sätze P: 201-302+352-308+313 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Giftig (T) R- und S-Sätze R: 61-20/21 S: 53-45 MAK 10 ml·m−3 (oder 36 mg·m−3)[1]
LD50 4930 mg·kg−1 (Ratte, peroral)[2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Dimethylacetamid (DMAc), genauer N,N-Dimethylacetamid, ist ein Amid der Essigsäure. DMAc wird als polares, organisches Lösungsmittel eingesetzt.
Inhaltsverzeichnis
Herstellung
Die großtechnische Herstellung von DMAC erfolgt durch die Umsetzung von Essigsäure mit Dimethylamin und anschließende Dehydratisierung des Reaktionsgemisches:
- CH3–COOH + (CH3)2NH → [CH3–COO]− x [(CH3)2NH2]+
- [CH3–COO]− x [(CH3)2NH2]+ → CH3–CO–N–(CH3)2 + H2O
Die Produktaufarbeitung und Reinigung erfolgt mittels Destillation.
Eigenschaften
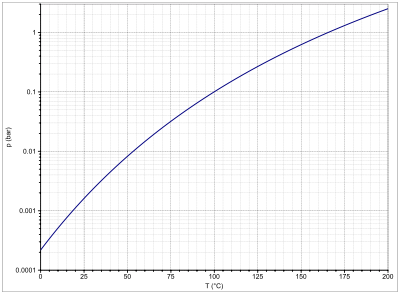
N,N-Dimethylacetamid ist eine hygroskopische, farblose bis gelbliche Flüssigkeit mit schwachem Geruch, welche mischbar mit Wasser ist. Die Verbindung ist bis zum Siedepunkt in Abwesenheit von katalytisch wirkenden Stoffen wie Wasser, Säuren, Basen und Alkoholen gegenüber Licht und Luft stabil.[2] Sie zersetzt sich in der Hitze, wobei Stickstoffoxide, Kohlenmonoxid und Kohlendioxid entstehen.[1] Seine wässrige Lösung reagiert sauer.[1] Die Dampfdruckkurve lässt sich mit der Antoine-Gleichung als log10(p) = A−(B/(T+C)) (p in bar, T in K) mit A = 4,88722, B = 1889,1 und C = −52,15 beschreiben.[4] Als kritische Daten sind die kritische Temperatur mit Tc = 384,85 °C, der kritische Druck mit pc = 40,3 bar und ein azentrischer Faktor mit ωc = 0,36351 bekannt.[5]
Die Verbindung bildet bei erhöhter Temperatur entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 66°C.[1] Der Explosionsbereich liegt zwischen 1,8 Vol% (64 g/m3) als untere Explosionsgrenze (UEG) und 11,5 Vol% (415 g/m3) als obere Explosionsgrenze (OEG).[1] Die Zündtemperatur beträgt 490°C.[6] Der Stoff fällt somit in die Temperaturklasse T1.
Verwendung
- DMAC ist ein Lösungsmittel zur Herstellung von Acrylfasern und von polyurethanbasierten Elastanfasern.
- DMAC wird als Lösungsmittel für Polyimidharze für Beschichtungen und Folien verwendet.
- DMAC kann sowohl als Lösungsmittel als auch als Reaktionspartner bei der Herstellung zahlreicher Feinchemikalien eingesetzt werden.
- Mischungen von DMAC mit Lithiumchlorid dienen als Lösungsmittel für Zellulosefasern.
Sicherheitshinweise
DMAC ist gesundheitsschädlich beim Einatmen und Berührung mit der Haut. Es reizt die Augen und wirkt sich mit größter Wahrscheinlichkeit teratogen auf das ungeborene Kind aus. DMAC ist nicht kanzerogen beziehungsweise mutagen bei Prüfungen an Mikroorganismen oder an Säugerzellkulturen.
Einzelnachweise
- ↑ a b c d e f g h i j k Eintrag zu CAS-Nr. 127-19-5 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 14. Juni 2011 (JavaScript erforderlich).
- ↑ a b c Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b Eintrag zu CAS-Nr. 127-19-5 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ I.M. Smallwood: Handbook of Organic Solvent Properties, S. 249, Arnold London 1996, ISBN 0 340 64578 4.
- ↑ Schmidt, J.: Auslegung von Sicherheitsventilen für Mehrzweckanlagen nach ISO 4126-10 in Chem. Ing. Techn. 83 (2011) 796–812, doi:10.1002/cite.201000202.
- ↑ E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen - Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
Wikimedia Foundation.