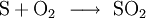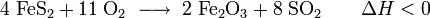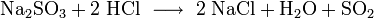- E220
-
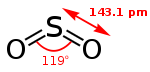
Strukturformel 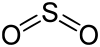
Allgemeines Name Schwefeldioxid Andere Namen Schwefel(IV)-oxid, Schwefligsäureanhydrid
Summenformel SO2 CAS-Nummer 7446-09-5 PubChem 1119 Kurzbeschreibung farbloses, stechend riechendes, giftiges Gas Eigenschaften Molare Masse 64,06 g·mol−1 Aggregatzustand gasförmig
Dichte 2,73 kg·m−3 (1 bar, 15 °C) [1]
Schmelzpunkt −75 °C [1]
Siedepunkt −10 °C [1]
Dampfdruck 3,3 bar [1] (21 °C)
Löslichkeit gut (112 g/l [1]) in Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Giftig (T) R- und S-Sätze R: 23-34 S: (1/2)-9-26-36/37/39-45 MAK 1,3 mg·m−3 [3]
LD50 2520ppm (Ratte, inhalation) [4]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Schwefeldioxid, SO2, ist das Anhydrid der schwefligen Säure H2SO3. Schwefeldioxid ist ein farbloses, schleimhautreizendes, stechend riechendes und sauer schmeckendes, giftiges Gas. Es ist sehr gut (physikalisch) wasserlöslich und bildet mit Wasser in sehr geringem Maße schwefelige Säure.Es entsteht vor allem bei der Verbrennung von schwefelhaltigen fossilen Brennstoffen wie Kohle oder Erdölprodukten, die bis zu 4 Prozent Schwefel enthalten. Dadurch trägt es in erheblichem Maß zur Luftverschmutzung bei, es ist der Grund für sauren Regen, wobei das Schwefeldioxid zunächst von Sauerstoff zu Schwefeltrioxid oxidiert wird und dann mit Wasser zu Schwefelsäure (H2SO4) umgesetzt wird.[5] Um dies zu verhindern gibt es verschiedene Verfahren zur Rauchgasentschwefelung.
Inhaltsverzeichnis
Herstellung
Schwefeldioxid kann durch verschiedene Verfahren hergestellt werden:
- durch Verbrennen von Schwefel oder Schwefelwasserstoff
- durch das Rösten von sulfidischen Erzen, z. B. von Pyrit:
- aus Sulfiten durch stärkere Säuren
Eigenschaften
Schwefeldioxid ist ein stechend riechendes, farbloses Gas. Es hat eine gute Wasserlöslichkeit, Lösungen sind dabei leicht sauer. Das Molekül ist gewinkelt:
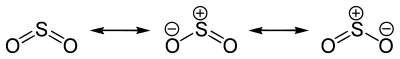
E-Nummer 220 kritische Temperatur 157,5 °C [3] kritischer Druck 79 bar [3] Schwefeldioxid ist mesomeriestabilisiert:
Verwendung
Flüssiges Schwefeldioxid löst zahlreiche Stoffe und hat sich daher als wertvolles Lösungsmittel etabliert.
In der Lebensmittelindustrie findet Schwefeldioxid als Konservierungs–,Antioxidations– und Desinfektionsmittel Verwendung, vor allem für Trockenfrüchte, Kartoffelgerichte, Fruchtsäfte, Marmelade und Wein. Wein- und Bierfässer werden zur Desinfizierung vor der Verwendung durch Behandlung mit SO2–Gas ausgeschwefelt.
Schwefeldioxid zerstört das Vitamin B1. In der EU ist es als Lebensmittelzusatzstoff der Nummer E 220 auch für „Bio“-Produkte zugelassen. Es dient auch zur Herstellung von Sulfurylchlorid SO2Cl2 und Thionylchlorid SOCl2.
Ferner ist Schwefeldioxid ein wichtiges Edukt zur Herstellung von Schwefeltrioxid, um anschließend konzentrierte Schwefelsäure z. B. mit dem Kontaktverfahren herzustellen.
Schwefeldioxid dient auch zur Herstellung von vielen Chemikalien, Medikamenten und Farbstoffen und zum Bleichen von Papier und Textilien.
Umweltverschmutzung
SO2 schädigt in hohen Konzentrationen Mensch, Tiere und Pflanzen. Die Oxidationsprodukte führen zu „Saurem Regen“, der empfindliche Ökosysteme wie Wald und Seen gefährdet, Gebäude und Materialien angreift. Die SO2-Emissionen der entwickelten Industriestaaten konnten jedoch in den letzten zwei Jahrzehnten durch die Nutzung schwefelarmer bzw. schwefelfreier Brenn- und Kraftstoffe stark reduziert werden.
Von allen Verkehrsträgern leistet der internationale Schifffahrtsverkehr den höchsten Emissionsbeitrag. Verschärfte Auflagen für PKW und LKW-Kraftstoffe führten in der Vergangenheit dazu, dass der beim Raffinieren entfernte Schwefel entsorgt wurde, indem er dem in der Schifffahrt verwendeten Schweröl zugesetzt wurde. Dort liegt der maximal zulässige Schwefelgehalt derzeit bei 4,5 Prozent. Die IMO hat den Grenzwert jedoch reduziert: Bis 2012 soll er auf 3,5 und bis 2020 auf 0,5 Prozent gesenkt werden. Diese Grenze gilt bereits heute für kalifornische Küstengewässer.[6] In der Ost- und Nordsee gibt es Schwefelemissionsüberwachungsgebiete, in denen der Grenzwert heute 1,5 Prozent beträgt. Bis zum Jahr 2010 soll er auf 1 Prozent und bis 2015 auf 0,1 Prozent abgesenkt werden. Selbst dann ist dieser Kraftstoff noch 100 mal schmutziger, als der in Europa für Nutzfahrzeuge zugelassene Dieselkraftstoff.[7]
Das Max-Planck-Institut für Meteorologie konnte im Rahmen einer Studie zeigen, dass in der Umgebung der stark frequentierten Seehäfen Rotterdam, Antwerpen und Milford Haven eine erheblich dichtere Wolkendecke herrscht als im Umland. Schwefeldioxid und Stickoxide wirken als Kondensationskeime und regen die Wolkenbildung an. Das durch diese Wolkendecke verstärkte Albedo führte zu einer Verringerung der Sonnenenergie, die die darunterliegenden Gebiete erhalten.[8]
Sicherheitshinweise
Eine Schwefeldioxidkonzentration, die über dem MAK-Wert liegt, kann beim Menschen zu Kopfschmerzen, Übelkeit und Benommenheit führen. In höheren Konzentrationen schädigt das Gas stark die Bronchien und Lungen oder sogar die Nucleinsäuren, die Träger der Erbeigenschaften.
Quellen
- ↑ a b c d e Sicherheitsdatenblatt (Praxair)
- ↑ Eintrag zu CAS-Nr. 7446-09-5 im European chemical Substances Information System ESIS
- ↑ a b c Eintrag zu CAS-Nr. 7446-09-5 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 30. März 2008 (JavaScript erforderlich)
- ↑ Sulfur dioxide bei ChemIDplus
- ↑ Holleman-Wiberg: Lehrbuch der Anorganischen Chemie 102. Auflage, de Gruyter, Berlin, 2007. ISBN 978-3-11-017770-1
- ↑ Neuer Antrieb für Schiffe Online auf www.wiwo.de
- ↑ Schiffe werden Umweltfreundlicher Online auf www.taz.de
- ↑ Dicke Luft am Meer Online bei www.planet-erde.de
Wikimedia Foundation.