- Ethylendiamin
-
Strukturformel 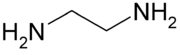
Allgemeines Name Ethylendiamin Andere Namen - Ethan-1,2-diamin (IUPAC)
- 1,2-Diaminoethan
Summenformel C2H8N2 CAS-Nummer 107-15-3 PubChem 3301 Kurzbeschreibung Eigenschaften Molare Masse 60,10 g·mol−1 Aggregatzustand flüssig
Dichte 0,90 g·cm–3[2]
Schmelzpunkt Siedepunkt 116 °C[2]
Dampfdruck Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 



Gefahr
H- und P-Sätze H: 226-312-302-314-334-317 EUH: keine EUH-Sätze P: 280-305+351+338-304+340-302+352-309-310 [2] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Ätzend (C) R- und S-Sätze R: 10-21/22-34-42/43 S: (1/2)-23-26-36/37/39-45 MAK nicht vergeben[2]
LD50 500 mg·kg−1 (Ratte, peroral)[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Ethylendiamin (kurz EDA, als Ligand auch en) ist der gebräuchliche Name für Ethan-1,2-diamin (1,2-Diaminoethan). Es gehört zur Stoffklasse der Amine.
Inhaltsverzeichnis
Eigenschaften
Ethylendiamin ist eine starke Base und in reiner Form eine farblose Flüssigkeit. Bei Kontakt mit Luft bildet sich mit dem darin enthaltenen Kohlendioxid weißes Ethylendiamincarbonat, das aufgrund des hohen Dampfdruckes von EDA auch als weißen Nebel auftreten kann.
Herstellung
Großtechnisch wird Ethylendiamin durch Umsetzung von 1,2-Dichlorethan mit Ammoniak unter Druck bei 180°C im wässrigen Medium hergestellt:[4]
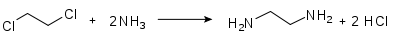
Dabei bildet sich Chlorwasserstoff, der zunächst als Hydrochlorid des Amins in gebundener Form vorliegt. Das Amin wird durch Zugabe von Natriumhydroxid in seine freie Form überführt und kann anschließend durch Rektifikation aus dem Gemisch gewonnen werden. Als Nebenprodukte werden Diethylentriamin (DETA) und Triethylentetramin (TETA) gebildet.
Ein weiteres großtechnisches Verfahren zur Herstellung von Ethylendiamin ist die Synthese ausgehend von Monoethanolamin und Ammoniak:[5]
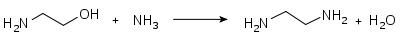
Dieses Verfahren findet in der Gasphase in Gegenwart von Nickelkatalysatoren statt.
Verwendung
Aufgrund der zwei als Elektronenpaardonator wirksamen Stickstoffatome ist Ethylendiamin ein wichtiger Chelatligand in der Komplexchemie. In Formeln wird er dort meist mit en abgekürzt. Weiterhin dient es als Lösungsmittel, Stabilisator, zur Säureneutralisation in Ölen und wird in der Synthese von Arzneimitteln, Schädlingsbekämpfungsmitteln, Kunstharzen und Kautschuk-Chemikalien benötigt.
Einzelnachweise
- ↑ a b c Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b c d e f g Eintrag zu CAS-Nr. 107-15-3 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30.12.2007 (JavaScript erforderlich).
- ↑ a b Eintrag zu CAS-Nr. 107-15-3 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Hans-Jürgen Arpe, Industrielle Organische Chemie, 6. Auflage (2007), Seite 245, Wiley VCH
- ↑ Hans-Jürgen Arpe, Industrielle Organische Chemie, 6. Auflage (2007), Seite 275, Wiley VCH
Kategorien:- Gesundheitsschädlicher Stoff
- Sensibilisierender Stoff
- Ätzender Stoff
- Diamin
- Chelatligand
Wikimedia Foundation.
