- Fluorenon
-
Strukturformel 
Allgemeines Name Fluorenon Andere Namen - Fluoren-9-on
- Diphenylenketon
Summenformel C13H8O CAS-Nummer 486-25-9 Kurzbeschreibung gelbe Schuppen[1]
Eigenschaften Molare Masse 180,21 g·mol−1 Aggregatzustand fest
Dichte 0,9 g·cm−3 (20 °C) [1]
Schmelzpunkt Siedepunkt 342 °C [1]
Löslichkeit - unlöslich in Wasser[2]
- löslich in Ethanol, Aceton, Diethylether und heißer Schwefelsäure[2]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Fluorenon ist ein Derivat des Fluorens (ein polyzyklischer aromatischer Kohlenwasserstoff) und gehört zur Gruppe der Aromaten und der Ketone. Unterschied zum Fluoren ist die Ketogruppe am kleineren Fünfring (in der 9-Position).
Inhaltsverzeichnis
Geschichte
Derivate des Fluorenons waren die ersten Medikamente weltweit mit einer nachgewiesenen Wirksamkeit gegen Viren (Tilorone, seit ca. 1970). Die klinische Anwendung wurde jedoch auf Grund von Nebenwirkungen eingestellt.
Gewinnung und Darstellung
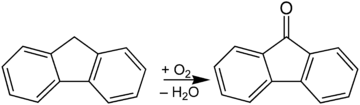
Fluorenon wird durch Oxidation von Fluoren im basischen Milieu hergestellt:
Weiterhin entsteht es (wie das Fluoren) in geringer Konzentration auch bei der Verbrennung von Benzin und Diesel.Eigenschaften
Der reine Stoff ist eine brennbare, gelbe, kristalline Festsubstanz. Fluorenon besitzt in Lösung eine auffällige, intensive Färbung, welche seine Verwendung in der Chromatographie erklärt. Die im Vergleich zu Fluoren dunklere (gelbe) Farbe resultiert aus der Erweiterung des aromatischen Systems auf das Sauerstoffatom (durch konjugierte Doppelbindungen).
Verwendung
Fluorenon wird als Farbstoff bei der Säulenchromatographie eingesetzt. Einige Derivate wurden schon früher als Anti-Viren-Medikamente (Virostatika) verwendet. Zur Zeit laufen Forschungen zur Entwicklung von neuen Chemotherapeutika und Virostatika aus Fluorenon (analog dem Tilorone). Durch passende Substituenten am Molekül soll die Wirksamkeit maximiert und die Nebenwirkungen sollen minimiert werden.
Sicherheitshinweise
Im Gegensatz zu Fluoren wirkt Fluorenon nicht akut toxisch. Es ist ein starkes Mitogen. Deswegen vermutete karzinogene Eigenschaften lassen sich nicht belegen. Das Fluorenderivat 4-Acetylaminofluoren (AAF) hingegen wirkt auf Tier und Mensch krebserzeugend.[3][4]
Siehe auch
Einzelnachweise
- ↑ a b c d e Eintrag zu Fluoren-9-on in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2008 (JavaScript erforderlich)
- ↑ a b Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ Vermutete kanzerogene Wirkung von Fluorenen
- ↑ Mitogene Wirkung von Fluoren und Fluorenon
Weblinks
- Oxidation von Fluoren (PDF-Datei; 15 kB)
- 9-Fluorenon-Carboxamide (PDF-Datei)
- Säulenchromatographie mit Fluorenon
Wikimedia Foundation.