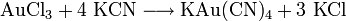- Goldtrichlorid
-
Strukturformel -chlorid_svg.png)
Allgemeines Name Gold(III)-chlorid Andere Namen Goldtrichlorid
Summenformel AuCl3 (Au2Cl6) CAS-Nummer 13453-07-1 Kurzbeschreibung roter, kristalliner Feststoff Eigenschaften Molare Masse 303,3 g·mol−1 Aggregatzustand fest
Dichte 3,9 g·cm−3 [1]
Schmelzpunkt 254 °C [1](Zersetzung)
Löslichkeit gut löslich in Wasser: 680 g·l−1 (20 °C) und Ethanol [1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Ätzend (C) R- und S-Sätze R: 34 S: 26-36/37/39 MAK noch nicht festgelegt[2]
WGK 1[2] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Gold(III)-chlorid ist eine der wichtigsten Goldverbindungen mit der Verhältnisformel AuCl3. In dieser Verbindung besitzt Gold mit der Oxidationsstufe +3 die stabilste Oxidationsstufe Gold in Verbindungen und Komplexen. Andere Goldchloride sind AuCl und AuCl2. AuCl2 ist allerdings keine Gold(II)-Verbindung, sondern eine gemischtvalente Au(I)-, Au(III)-Verbindung. Gold(III)-chlorid ist sehr hygroskopisch und gut in Wasser und Ethanol löslich. In Salzsäure löst sich AuCl3 unter Bildung von Tetrachlorogoldsäure.
Inhaltsverzeichnis
Gewinnung und Darstellung
Gold(III)-chlorid wird durch Überleiten von Chlorgas über feinverteiltes Gold bei 180 °C hergestellt.
Struktur
AuCl3 liegt sowohl im Festkörper als auch in der Dampfphase als Dimer Au2Cl6 vor. Gleiches gilt auch für das Goldbromid AuBr3. Im Gegensatz zum ebenfalls dimeren Aluminiumchlorid sind die Gold(III)-chlorid-Dimere eben angeordnet, die AuCl4-Einheit ist quadratisch-planar. Bei (AlCl33)2 ist sie tetraedrisch aufgebaut und die Brückenatome liegen ober- und unterhalb der Ebene. Die Au-Cl-Bindung ist stark kovalent aufgebaut, dies ist durch die (vergleichsweise) hohe Elektronegativität des Goldes und die hohe Oxidationsstufe bedingt.
Chemische Eigenschaften
Bei Temperaturen über 250 °C zerfällt AuCl3 in AuCl und Cl2.
AuCl3 ist eine Lewis-Säure und bildet viele Komplexe der Form M+AuCl4− (Tetrochloroaurate). M kann beispielsweise Kalium sein. Dieses AuCl4−-Ion ist aber in wässriger Lösung nicht sehr stabil.
In wässriger Lösung reagiert AuCl3 mit Alkalihydroxiden (beispielsweise Natriumhydroxid) zu Au(OH)3. Dieses reagiert beim Erhitzen an der Luft zu Gold(III)-oxid Au2O3 und weiter zu metallischem Gold.
Verwendung
Gold(III)-chlorid wird häufig als Ausgangssubstanz zur Herstellung von anderen Goldverbindungen und Komplexen verwendet. Ein Beispiel ist die Herstellung des Cyanid-Komplexes KAu(CN)4
Anwendungen in der organischen Chemie:
Gold(III)-Salze, vor allem NaAuCl4 (aus AuCl3 und Natriumchlorid)) können in der organischen Synthese als Katalysator in Reaktionen mit Alkinen eingesetzt werden. Sie dienen dort als ungiftiger Ersatz für Quecksilber(II)-Salze. Ein wichtiges Beispiel ist die Hydratation von terminalen Alkinen, um mit hoher Ausbeute Methylketone zu erhalten. Auch Amine kann man auf ähnliche Weise herstellen. [3]
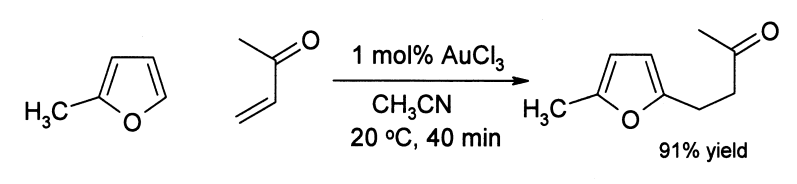
Gold(III)-chlorid kann als milder Katalysator für die Alkylierung von aromatischen und heteroaromatischen Verbindungen genutzt werden. Ein Beispiel ist die Alkylierung von 2-Methylfuran mit Methylvinylketon. [4]
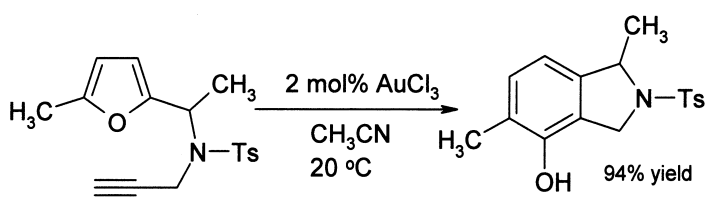
Aus Furanderivaten und Alkinen kann in einer Umlagerung unter Katalyse von Gold(III)-chlorid ein Phenol gebildet werden. [5]
Quellen
- ↑ a b c d Sicherheitsdatenblatt (alfa-aesar)
- ↑ a b Eintrag zu CAS-Nr. 13453-07-1 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 12.01.08 (JavaScript erforderlich)
- ↑ Y. Fukuda, K. Utimoto, J. Org. Chem. 56, 3729-3731 (1991)
- ↑ G. Dyker, An Eldorado for Homogeneous Catalysis?, in Organic Synthesis Highlights V, H.-G. Schmaltz, T. Wirth (eds.), pp 48–55, Wiley-VCH, Weinheim, 2003)
- ↑ A. S. K. Hashmi, T. M. Frost, J. W. Bats, J. Am. Chem. Soc. 122, 11553-11554 (2000)
Literatur
- Holleman-Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Verlag de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage, VCH Verlagsgesellschaft, Weinheim 1988, ISBN 3-527-26169-9.
- Handbook of Chemistry and Physics. 71st edition, CRC Press, Ann Arbor/Michigan 1990.
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 780, ISBN 978-0-911910-00-1.
- H. Nechamkin: The Chemistry of the Elements. McGraw-Hill, New York 1968.
- A. F. Wells: 'Structural Inorganic Chemistry. 5th ed., Oxford University Press, Oxford, UK, 1984. (engl.)
- G. Dyker: An Eldorado for Homogeneous Catalysis?. In: H.-G. Schmaltz, T. Wirth (eds.): Organic Synthesis Highlights V. Wiley-VCH, Weinheim 2003, pp 48–55.
Wikimedia Foundation.

-chloride-dimer-3D-vdW.png)