- 2-Aminophenol
-
Aminophenole Name o-Aminophenol m-Aminophenol p-Aminophenol Andere Namen 2-Aminophenol,
2-Hydroxyanilin3-Aminophenol,
3-Hydroxyanilin4-Aminophenol,
4-HydroxyanilinStrukturformel 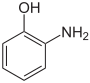
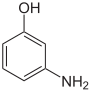

CAS-Nummer 95-55-6 591-27-5 123-30-8 27598-85-2 (Isomerengemisch)[1] PubChem 5801 11568 403 Summenformel C6H7NO Molare Masse 109,13 g·mol−1 Aggregatzustand fest Kurzbeschreibung farbloser Feststoff Schmelzpunkt 172–174 °C[2] 122 °C[3] 190 °C[4] Siedepunkt 150 °C (15 mbar)[2] 164 °C (15 mbar)[3] 284 °C (Zers.)[4] Löslichkeit 17 g/l (20 °C)[2] 26 g/l (20 °C)[3] 6,5 g/l (24 °C)[4] wenig löslich in Wasser, löslich in Ethanol, Ether, Säuren und Basen Gefahrstoff-
kennzeichnung
[2][3][4]
Gesundheits-
schädlich(Xn) 

Gesundheits-
schädlichUmwelt-
gefährlich(Xn) (N) 

Gesundheits-
schädlichUmwelt-
gefährlich(Xn) (N) R-Sätze 20/22-68 20/22-51/53 20/22-68-50/53 S-Sätze (2)-28-36/37 (2)-28-61 (2)-28-36/37-60-61 Die Aminophenole (auch Hydroxyaniline; Summenformel C6H7NO) sind aromatische Verbindungen und leiten sich sowohl vom Anilin als auch vom Phenol ab. Durch unterschiedliche Anordnung der Substituenten ergeben sich drei Konstitutionsisomere. Sie dienen u. a. zur Herstellung von Arzneimitteln, Farbstoffen und photographischen Entwicklern. Die Methylether bilden die Gruppe der Anisidine.
Inhaltsverzeichnis
Eigenschaften
Die Aminophenole sind feste farblose Stoffe. Sie verfärben sich bei Einwirkung von Luft grau bis dunkelgrau. Sie sind wenig löslich in Wasser, löslich in Ethanol und Ether. Da sie sowohl eine Hydroxygruppe als auch eine Aminogruppe besitzen, sind sie in Säuren und Basen löslich. In basischem Milieu können o- und p-Aminophenol von starken Oxidationsmitteln reversibel zu den entsprechenden Chinoniminen umgesetzt werden (vgl. Indophenol, siehe auch Chinone).
Darstellung
p-Aminophenol wird durch elektrolytische Reduktion von Nitrophenol in stark schwefelsaurer Lösung hergestellt.[5]
Verwendung
Der Farbstoff Indophenol lässt sich durch oxidative Kupplung von p-Aminophenol mit Phenol in alkalischer Lösung mit Natriumhypochlorid als Oxidationsmittel herstellen. Die Aminophenole dienen auch zur Darstellung zahlreicher Azofarbstoffe.
Momme Andresen entdeckte 1888, dass p-Aminophenol als flüssiger Entwickler für die Schwarz-Weiß-Photographie eingesetzt werden kann. Es ist unter dem Handelsnamen Rodinal bekannt.[5]
Aus p-Aminophenol leiten sich u. a. Phenacetin und Paracetamol ab. Sie dienen beide als Arzneistoffe zur Schmerzbehandlung und Fiebersenkung.
Bei der Polykondensation von Aminophenolen mit Formaldehyd erhält man Kunstharze, die als Anionenaustauscher Bedeutung erlangt haben.
Einzelnachweise
- ↑ Eintrag zu CAS-Nr. 27598-85-2 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 24. März 2008 (JavaScript erforderlich).
- ↑ a b c d Eintrag zu CAS-Nr. 95-55-6 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 24. März 2008 (JavaScript erforderlich).
- ↑ a b c d Eintrag zu CAS-Nr. 591-27-5 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 24. März 2008 (JavaScript erforderlich).
- ↑ a b c d Eintrag zu CAS-Nr. 123-30-8 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 24. März 2008 (JavaScript erforderlich).
- ↑ a b Beyer/Walter: Lehrbuch der Organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 527.
Weblinks
Wikimedia Foundation.
