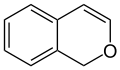
- Isochromen
-
Strukturformel 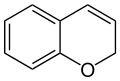
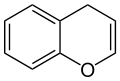
2H-Chromen (links) und 4H-Chromen (rechts)Allgemeines Name Chromen Andere Namen Benzopyran
Summenformel C9H8O CAS-Nummer - 254-04-6 (2H-C.)
- 254-03-5 (4H-C.)
Eigenschaften Molare Masse 132,16 g·mol−1 Aggregatzustand flüssig
Dichte - 1,0993 g·cm−3 (2H) [1]
Schmelzpunkt - < 25 °C (2H) [2]
Siedepunkt Löslichkeit - unlöslich in Wasser (2H) [1]
Sicherheitshinweise Gefahrstoffkennzeichnung 
unbekannt R- und S-Sätze R: ? S: ? LD50 - 250 mg·kg−1 (2H, Maus, intraperit.) [2][4]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Als Chromen (auch: Benzopyran) werden die beiden organischen chemischen Verbindungen 2H-Chromen und 4H-Chromen bezeichnet. Diese zählen zu den aromatischen Verbindungen und zu den Heterocyclen, da im Ringsystem das Heteroatom Sauerstoff enthalten ist. Beide Substanzen sind Isomere, die sich nur durch die Lage einer Doppelbindung unterscheiden.
Inhaltsverzeichnis
Vorkommen, Derivate und Verwendung
2H-Chromen kommt in dem Myrtengewächs Calyptranthes tricona vor. Derivate des 2H-Chromens wirken als potente Kaliumkanalöffner und werden als Arzneistoffe verwendet (Chromakalim, Lemakalim);[5] Carbocromen wird zur Herztherapie eingesetzt. Vom 2H-Chromen leiten sich Cumarin und Umbelliferon ab, vom 4H-Chromen das Chromon, die Anthocyanidine und Flavone. Durch Hydrierung des Pyran-Ringes erhält man das Chroman, das z. B. den Grundbaustein der Tocopherole, der Rotenoide und einiger Cannabinoide darstellt. Auch viele Alkaloide enthalten ein Chromen-Gerüst als Chromophor.[6]
Isochromene
Stellungsisomere der beiden Chromene sind das 1H-Isochromen und das 3H-Isochromen, bei denen sich das Sauerstoff-Atom in Position 2 befindet.
Darstellung
Eine einfache Einstufensynthese von 2H-Chromen nach Y. Kawase ist durch direkte Cyclisierung von Salicylaldehyd mit Propencarbonsäureestern in DMF möglich.[7][5]
Literatur
- J. Falbe(Hrsg.), M. Regitz (Hrsg.): Römpp Lexikon Chemie. 10. Auflage. Thieme, Stuttgart/New York 1996–1999.
Einzelnachweise
- ↑ a b c D. R. Lide, G. W. A. Milne: Handbook of Data on Common Organic Compounds. CRC Press, 1995, ISBN 9780849304040, S. 568
- ↑ a b 1,2-Benzopyran bei ChemIDplus
- ↑ D. R. Lide, G. W. A. Milne: Handbook of Data on Organic Compounds. 3. Auflage, CRC Press, 1994, ISBN 9780849304453, S. 1548
- ↑ European Journal of Medicinal Chemistry--Chimie Therapeutique. Vol. 11, Pg. 81, 1976.
- ↑ a b Sabine Plücker: Untersuchungen zur Darstellung von Radioliganden aus der Reihe der Kaliumkanalöffner vom Benzopyran-Typ (PDF), Dissertation an der Heinrich-Heine-Universität Düsseldorf, 2004
- ↑ I. W. Southon, G. A. Cordell, J. Buckingham: Dictionary of alkaloids. CRC Press, 1989, ISBN 9780412249105
- ↑ Kawase, Y., Yamaguchi, S., Horita, H., Takeno, J., Kameyama, H.: Bull. Chem. Soc. Jpn., 1982, 55, 1153-1155.
Wikimedia Foundation.