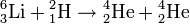- Isotope
-
Als Isotope bezeichnet man Nuklide in ihrem Verhältnis zueinander, wenn ihre Atomkerne gleich viele Protonen (gleiche Ordnungszahl), aber verschieden viele Neutronen enthalten. Die Isotope eines und desselben Elements haben also verschiedene Massenzahlen, verhalten sich aber chemisch weitgehend identisch. Die Bezeichnung Isotop ist historisch älter als der allgemeinere Begriff Nuklid und wird daher nach wie vor oft gleichbedeutend mit Nuklid benutzt.
Der Name (von griechisch ἴσος, ísos „gleich“ und τόπος, tópos „Ort, Stelle“) kommt daher, dass die Isotope eines und desselben Elements im Periodensystem am gleichen Ort stehen. Getrennt voneinander dargestellt werden sie in einer Nuklidkarte oder Isotopentabelle.
Der Begriff Isotop wurde von Frederick Soddy geprägt, der für seine Arbeiten und Erkenntnisse im Bereich der Isotope und Radionuklide 1921 den Nobelpreis für Chemie erhielt.
In der Regel besitzt jedes natürlich vorkommende Element ein oder wenige stabile Isotope, während seine übrigen Isotope radioaktiv (das heißt instabil) sind und früher oder später zerfallen. Es gibt jedoch auch Elemente, bei denen alle Isotope instabil sind.
Inhaltsverzeichnis
Schreibweise für Isotope
Um verschiedene Isotope eines Elementes zu kennzeichnen, wird die Massenzahl dem Elementsymbol links oben hinzugefügt. Die Kernladungszahl ist schon durch den Namen (das Elementsymbol) gegeben, kann aber zusätzlich links unten an das Elementsymbol geschrieben werden, sofern sie – z. B. bei Kernreaktionen – von Interesse ist, wie in
Im Fließtext wird oft einfach die Massenzahl an das Elementsymbol oder an den vollen Elementnamen mit Bindestrich angefügt, also z. B. U-235, Uran-235, C-14, Kohlenstoff-14, wie es auch der Sprechweise entspricht.
Tritt in der Bezeichnung noch ein m auf (z. B. 16m1N), so ist damit ein Kernisomer gemeint. Wenn hinter dem m eine Zahl steht, ist dies eine Nummerierung, falls mehrere Isomere existieren.
Chemische Reaktionen von Isotopen
In ihren chemischen Reaktionen unterscheiden sich Isotope des gleichen Elements nur dann, wenn die Massenunterschiede groß sind.
Bei schweren Elementen trifft das nicht zu; beispielsweise beträgt der Massenunterschied bei Uran-235 zu Uran-238 1:1,012766, obwohl drei Neutronen mehr enthalten sind. In ihrem chemischen Verhalten ist kein Unterschied, zum Trennen müssen physikalische Methoden eingesetzt werden (siehe Urananreicherung). Beim Lithium beträgt der Unterschied zwischen Li-6 und Li-7 1:1,1666; hier sind bereits physikalisch-chemische Trennmethoden möglich (siehe Lithium). Dagegen sind bei den drei Wasserstoffisotopen die Massenunterschiede sehr groß (1H:2H:3H wie 1:2:3), weshalb sie chemisch leicht unterschiedlich reagieren und eigene Namen sowie eigene Elementsymbole erhielten:
- Das weitaus häufigste Wasserstoffisotop 1H wird auch als Protium oder leichter Wasserstoff bezeichnet.
- Das Isotop 2H wird auch als Deuterium oder schwerer Wasserstoff bezeichnet. Elementsymbol: D.
- Das Isotop 3H wird auch als Tritium oder überschwerer Wasserstoff bezeichnet. Elementsymbol: T.
Ein Beispiel für das unterschiedliche chemische Verhalten von H und D tritt bei der Elektrolyse von Wasser auf, bei der bevorzugt Wasser mit dem normalen 1H reagiert und in Wasserstoff und Sauerstoff zerlegt wird, während sich D (2H Deuterium, Schwerer Wasserstoff) enthaltende Wassermoleküle im Restwasser anreichern (gegenüber dem natürlichen Mengenverhältnis von etwa 1:7000). Grund hierfür sind die verschiedenen Nullpunktsenergien dieser beiden Isotope.
Stabile Isotope
Mit 10 stabilen Isotopen hat Zinn die meisten natürlich vorkommenden Isotope. Von den 22 sogenannten Reinelementen oder anisotopen Elementen existiert nur jeweils ein stabiles Isotop. Dies sind: Beryllium, Fluor, Natrium, Aluminium, Phosphor, Scandium, Mangan, Cobalt, Arsen, Yttrium, Niob, Rhodium, Iod, Cäsium, Praseodym, Terbium, Holmium, Thulium, Gold.
Thorium besitzt zwar nur ein natürliches Isotop, dieses ist aber nicht stabil. Die Halbwertszeit ist mit 1,4 · 1010 Jahren sehr lang. In einigen Lehrbüchern wird es, wie auch Bismut, als Reinelement aufgeführt. Neueren Untersuchungen zufolge ist das bisher für stabil gehaltene Isotop des Bismuts ein Alpha-Strahler mit extrem langer Halbwertszeit (1,9 · 1019 Jahre).
Bekannte Isotope
Wasserstoff
Schwerer Wasserstoff (2H oder Deuterium) dient im Schwerwasserreaktor als Moderator. Überschwerer Wasserstoff (3H oder Tritium) ist radioaktiv. Er entsteht z. B. in der Atmosphäre durch die kosmische Strahlung und auch in Kernreaktoren. Tritium wurde zwischen etwa 1960 und 1998 in Leuchtfarben für Uhr-Zifferblätter usw. verwendet. In größeren Mengen soll es in Zukunft als ein Teil des Brennstoffs für Kernfusionsreaktoren erzeugt und gebraucht werden.
Kohlenstoff
Ein bekanntes Isotop ist das radioaktive 14C, das zur Altersbestimmung von organischen Materialien (Archäologie) benutzt wird (Radiokarbonmethode). Kohlenstoff (C) liegt hauptsächlich in den stabilen Isotopen 12C und 13C vor.
Sauerstoff
Zur Untersuchung von Paläo-Temperaturen wird vor allem das Verhältnis der beiden stabilen Sauerstoffisotope 18O und 16O herangezogen.
Uran
Das Isotop 235U dient als Brennstoff in Kernkraftwerken. Für die meisten Reaktortypen muss das Natururan dazu an 235U angereichert werden. Fast reines 235U wird in Kernwaffen verwendet. Die gleiche Verwendung hat 239Pu. In den meisten Kernwaffen wird heute Plutonium verwendet, da es ohne zusätzlichen Anreicherungsprozess aus abgebranntem Kernreaktorbrennstoff gewonnen werden kann.
Plutonium
238Pu wird wegen seiner radioaktiven Zerfallswärme in der Raumfahrt zur Stromerzeugung in Radioisotopengeneratoren verwendet, wenn Solarzellen wegen zu großer Sonnenentfernung nicht mehr einsetzbar sind.
Isotope in der Analytik
(Siehe auch Isotopenuntersuchung)
In Messungen des optischen Spektrums mit genügender Auflösung können Isotope eines Elements an ihren Spektrallinien unterschieden werden (Isotopieverschiebung).
Die Isotopenzusammensetzung in einer Probe wird in der Regel mit einem Massenspektrometer bestimmt, im Fall von Spurenisotopen mittels Beschleuniger-Massenspektrometrie.
Radioaktive Isotope können oft anhand ihrer Zerfallsprodukte oder der abgegebenen ionisierenden Strahlung identifiziert werden.
Isotope spielen ferner eine Rolle in der NMR-Spektroskopie. So wird beispielsweise in der NMR-Spektroskopie organischer Verbindungen die Konzentration von 13C gemessen, da dieses Isotop im Gegensatz zum viel häufigeren 12C einen von null verschiedenen Kernspin und damit ein magnetisches Moment hat.
Isotope werden auch in der Aufklärung von Reaktionsmechanismen oder Metabolismen mit Hilfe der sogenannten Isotopenmarkierung verwendet.
Die Isotopenzusammensetzung des Wassers ist an verschiedenen Orten der Welt verschieden und charakteristisch. Diese Unterschiede erlauben es etwa bei Lebensmitteln wie Wein oder Käse, die Deklaration des Ursprungsortes zu überprüfen.
Die Untersuchung von bestimmten Isotopen-Mustern (insbesondere 13C-Isotopen-Mustern) in organischen Molekülen wird als Isotopomeren-Analyse bezeichnet. Sie erlaubt unter anderem die Bestimmung intrazellulärer Stoffflüsse in lebenden Zellen. Darüber hinaus ist die Analyse von 13C/12C-, 15N/14N- sowie 34S/32S-Verhältnissen in der Ökologie heute weit verbreitet. Anhand der Fraktionierung lassen sich Stoffflüsse in Nahrungsnetzen nachverfolgen oder die Trophieebenen einzelner Arten bestimmen.
Die Geochemie befasst sich mit deren Isotopen in Mineralen, Gesteinen, Boden, Wasser und Atmosphäre.
Siehe auch
- Radionuklid
- Fajans-soddysche Verschiebungssätze (1913 Kasimir Fajans und Frederick Soddy)
- Liste der Isotope
- PSE mit Anzahl der Isotopen
- Isotopentabelle
Weblinks
Wikimedia Foundation.